LGR5がん細胞は再発原因の最有力候補であったがまだ証拠をつかめていなかった
慶應義塾大学は7月8日、大腸がんの増殖を司るヒトの「がん幹細胞」が化学療法後も死滅せず、再燃・再発につながるメカニズムを初めて解明したと発表した。この研究は、同大医学部坂口光洋記念講座オルガノイド医学の太田悠木研究員、藤井正幸専任講師、佐藤俊朗教授らの研究グループによるもの。研究成果は「Nature」誌に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
日本の大腸がん罹患者数は全がんの中で第1位であり、2020年の死亡数は女性で第1位、男性では第3位と、社会に大きな影を落としている。近年の化学療法の進歩によって、切除できない進行がんの治療成績は向上しているが、一部のがん細胞は化学療法後も生き残り、再燃・再発を導くため、大腸がんによる死亡数は依然として高い水準に留まっている。そのため、がんの再燃・再発のメカニズムを理解し、有効な治療方法を開発することが急務だが、技術的な課題から困難だった。
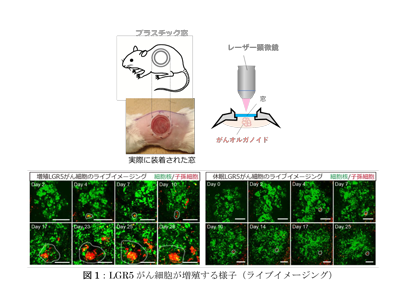
研究グループは先行研究において、体外でヒトの大腸上皮細胞を増殖させるオルガノイド技術を開発。それを応用してヒトの大腸がんオルガノイドをマウスに移植し、体内の大腸がんを模倣したがん組織を作り出すことに成功した。その結果、これまで観察できなかったがん細胞の振る舞いを研究できるようになり、2017年には、さらにこの技術を駆使し、がんの形成・成長に重要な役割を果たすヒト大腸がんのがん幹細胞が存在することを示した。LGR5と呼ばれる分子を発現する大腸がん細胞(LGR5がん細胞)ががん幹細胞であることを細胞系譜解析によって実証するとともに、マークしたLGR5がん細胞が蛍光で光るがん組織を作り出す様子を描き出した。そして、LGR5がん細胞ではないがん細胞からは、新しいがん組織は出現しなかった。がん幹細胞は、がんの再燃・再発原因の最有力候補でありながら、これらの技術をもってしても、手がかりをつかめていなかった。その理由の1つは、大腸がんオルガノイドをマウスの皮下に埋め込むため、1つ1つのがん細胞を観察できないことにあった。
絶え間なく増殖、がん消失、休眠状態の3通りの動態パターンがあることをライブイメージングにより確認
今回の研究では、このボトルネックを克服し、大腸がん幹細胞の一部が休眠状態にあるために、化学療法の耐性やがん再発を導くことを実証した。さらに、大腸がん幹細胞がどのように休眠状態を維持し、がんの再燃・再発を導くか、その分子メカニズムを明らかにした。
研究グループはまず、がん幹細胞の動態を細胞レベルで可視化するために、移植オルガノイドを覆うマウスの皮膚を取り除き、かわりに透明な窓を埋め込んだ。この窓を通して、1つ1つのLGR5がん細胞が、光る腫瘍を作り出していく様をリアルタイムで観察することができるようになった。このライブイメージングによって、LGR5がん細胞の動態に3通りのパターンがあることを確認した。LGR5がん細胞の約24%は、絶え間ない増殖とともに大きな腫瘍を作り出し、その一方で約54%は、途中でがん細胞が消失し、新しい腫瘍を作り出すことができなかった。これは、細胞同士が競い合い、勝ったものは新しい腫瘍を作り、負けた方は消失してしまったためだという。興味深いことに、残りの約21%のLGR5がん細胞は、観察中にほとんど分裂せず、休眠状態にあった。
休眠LGR5がん細胞は化学療法に耐えて生き残り、増殖していたがん細胞のほとんどは消滅
研究グループは、この休眠状態にあるLGR5がん細胞こそが、がんの再燃・再発の主因と考えた。そこで、休眠状態のLGR5がん細胞は、細胞周期の休止期にあり、p27というマーカーを発現することを見出し、ヒト大腸がんオルガノイドのLGR5とp27を発現する細胞をそれぞれ赤色蛍光と緑色蛍光で光らせるよう加工することで、休眠状態のLGR5がん細胞(休眠LGR5がん細胞)と、p27を発現しないLGR5がん細胞(増殖LGR5がん細胞)を可視化した。このようなヒト大腸がんオルガノイドをマウスに移植し、ライブイメージングでその動態を観察した。
その結果、休眠LGR5がん細胞が生体内で休眠状態を維持する一方、増殖LGR5がん細胞は絶え間なく増殖することがわかった。また、移植したマウスに化学療法薬剤を投与すると、休眠LGR5がん細胞は化学療法に耐えて生き残り、増殖LGR5がん細胞のほとんどは消滅した。さらに、化学療法の投与を止めた後にがん細胞を追跡したところ、休眠LGR5がん細胞は増殖を再開し、腫瘍を形成することがわかった。これらから、ヒト大腸LGR5がん細胞は、休眠中は化学療法に耐え、覚醒後はがん幹細胞としてがんの再燃・再発に関与することが示された。
基底膜につなぎとめるコラーゲンタンパク質がFAK-YAPシグナルを介して休眠状態を制御
次に、ヒト大腸休眠LGR5がん細胞ががん幹細胞として独自の細胞周期を維持するメカニズムについて検討を進め、COL17A1と呼ばれるコラーゲンタンパク質が関与していることを突き止めた。COL17A1は大腸がん細胞をその真下にある基底膜に強固につなぎとめている。休眠LGR5がん細胞は増殖LGR5がん細胞に比べCOL17A1の発現が増加しており、細胞と基底膜の接着状態が休眠状態を制御していると考えられた。次にCOL17A1が休眠状態を司るかどうかを調べるため、ゲノム編集技術を使用して大腸がんオルガノイドのCOL17A1遺伝子をノックアウトした。COL17A1が発現できなくなった大腸がんのLGR5がん細胞はp27を喪失し、休眠状態をとれず、そのオルガノイドには、化学療法が奏功した。また、COL17A1をノックアウトした大腸がんオルガノイドにCOL17A1を再び発現させると、休眠LGR5がん細胞が再び出現した。この結果から、休眠LGR5がん細胞は、COL17A1で基底膜に固着して休眠状態を維持し、化学療法に対する耐性をもつことがわかった。
さらに、COL17A1による接着がどのようにして休眠LGR5がん細胞を休眠状態に保つかを調べた。その結果、COL17A1による接着がなくなると、FAKおよびYAPというシグナルが活性化し、休眠LGR5がん細胞は休眠から起こされて増殖を始めた。一方、この状況で、YAPシグナルを薬剤で阻害すると、休眠LGR5がん細胞は休眠したままだった。このことから、休眠LGR5がん細胞はCOL17A1を介した安定的な接着によってFAK-YAPシグナルを抑制し、休眠状態を維持していることが示唆された。
そこで、研究グループは、化学療法後に生き残ったがん細胞からがんが再発する過程で、COL17A1-FAK-YAP経路がどう関与しているかを調べた。その結果、化学療法に曝されたヒト大腸がん細胞オルガノイドは、コラーゲン分子を壊す酵素を産生し、COL17A1を破壊した。休眠状態を作り出していたCOL17A1がなくなった大腸がん細胞は、FAK-YAPシグナルを活性化させ休眠LGR5がん細胞を覚醒・増殖させた。従って、COL17A1は休眠状態を作り出して化学療法からがん細胞を守る一方、化学療法によって容易に破壊され、FAK-YAPシグナルの活性化とがん細胞の再増殖を導くことがわかった。
YAP標的治療によってがん再発阻止が可能、臨床応用に期待
化学療法後に残存した休眠LGR5がん細胞がYAPシグナルを活性化し、再増殖の準備をしていることが示唆されたため、研究グループは、動物モデルを用いてこの仮説を検証した。大腸がんオルガノイドを移植したマウスに化学療法を行い、その後にYAPシグナルを遺伝学的に減弱させたところ、化学療法後のがんの再発が有意に遅延した。さらにYAP標的治療の臨床応用を視野に入れ、薬剤(低分子TEAD阻害剤;TEADi)によるYAPシグナルの阻害を試みた結果、TEADi単独治療では弱い腫瘍抑制効果しか示しなかったが、化学療法(イリノテカン)の後にTEADiを投与すると、化学療法後の腫瘍再増殖が有意に抑制された。YAPシグナルを阻害する薬剤が、化学療法後の大腸がんの再燃・再発を防ぐ新しい治療効果を持つことが示され、がん治療のブレークスルーにつながる可能性が期待される。
今回の研究では、生体内イメージング、細胞系譜解析、患者由来大腸がんオルガノイドを統合し、休眠LGR5がん細胞が、化学療法の耐性および再燃・再発に関与することを示した。また、コラーゲンタンパク質COL17A1が休眠LGR5がん細胞のYAPシグナルを調節することによって休眠・増殖の状態を制御することを発見した。こうした結果に基づき、研究グループは、ヒト大腸がんオルガノイドの移植モデルを用い、次世代型YAPシグナル阻害剤(TEADi)による、がんの再発の阻止が可能であることを実証した。「今回の成果が今後臨床応用され、化学療法後のがんの再燃・再発を防ぐ新しい治療法となることが期待される」と、研究グループは述べている。
▼関連リンク
・慶応義塾大学 プレスリリース




