従来の抗菌剤、薬剤耐性菌に対する効果が薄いのに常在菌にも作用するという課題
東京慈恵会医科大学は7月5日、多剤耐性株を含む細菌、真菌、ウイルス等のさまざまな微生物病原体を近赤外光で選択的に除去することが可能となる世界初の治療戦略(photoimmuno-antimicrobial strategy, PIAS)を開発したと発表した。この研究は、同大消化器・肝臓内科の光永眞人講師、伊藤公博助教、西村尚助教、東京慈恵会医科大学総合医科学研究センター基盤研究施設の岩瀬忠行准教授、産業医科大学動物研究センターの宮田博規 教育教授、横浜市立大学医学部微生物学教室の梁明秀教授、宮川敬准教授、米国国立がん研究所の小林久隆主任研究員らの研究グループによるもの。研究成果は、「Communications Biology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ペニシリンの発見と後に続くさまざまな抗菌剤の開発によって、多くの感染症を治療することができるようになった。しかし、メチシリン耐性黄色ブドウ球菌(MRSA)を含む薬剤耐性病原体の出現により、治療は困難になっている。一方、抗菌剤の使用は病原体以外の常在菌にも作用するため、薬剤耐性状態にかかわらず、問題となる病原体のみを排除することができる治療法の開発が長年の課題だった。
薬剤耐性問題に加え、有効な治療法のない新たな感染症の出現も脅威となっている。特に2019年に突如として現れたSARS-CoV-2(新型コロナウイルス)による感染症は、世界的危機を引き起こした。今後出現するかもしれない新たな病原体に対しても、迅速に対応できる治療法の開発は喫緊の課題だ。
「がん光免疫療法」と「微生物学」を応用した治療法の開発
研究グループの光永眞人医師、小林久隆主任研究員らが2011年に開発したがん光免疫療法は、がん細胞に発現する標的のみを認識するモノクローナル抗体に、近赤外光に反応する化合物(IRDye700DX、IR700)を結合させた光反応性抗体を用いる。光反応性抗体が結合したがん細胞は近赤外光を受けることによって、選択的に死滅する。治療効果と安全性は種々の臨床試験によって確認され、2020年、日本において世界に先駆けて、頭頸部がんに対する新しい治療法として実用化された。また、岩瀬忠行准教授らは、黄色ブドウ球菌に対する微生物間干渉など、広く微生物学研究を進めている。
今回の研究では、これらのがん光免疫療法の原理と微生物学の研究を応用し、狙った病原体を選択的に排除可能な新しい感染症治療法の開発を目指した。
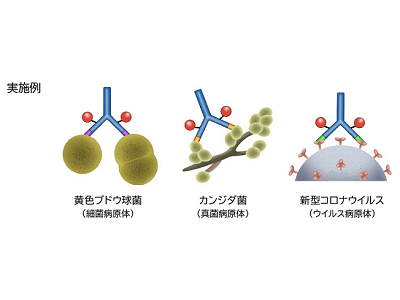
黄色ブドウ球菌、カンジダ菌、新型コロナウイルスに対して効果
細菌病原体である黄色ブドウ球菌に対する作用を検討するため、黄色ブドウ球菌に選択的なモノクローナル抗体にIR700を結合させた対黄色ブドウ球菌用の光反応性抗体を合成した。この光反応性抗体が結合した黄色ブドウ球菌は近赤外光を受けると、数分程度で死滅することが確認された。一方、この光反応性抗体が結合しない表皮ブドウ球菌や大腸菌などには影響は認められなかった。黄色ブドウ球菌に対する殺菌効果は薬剤耐性の状態に左右されることはなく、MRSAを含むさまざまな薬剤耐性株に対しても得られた。
抗菌剤は一般に正常細菌叢を含めた多種の細菌に治療効果を示すため、腸内細菌叢などのバランスに乱れが生じることが知られているが、開発した治療法による腸内細菌叢への影響はほとんど見られなかった。
さらに、真菌であるカンジダ菌や、新型コロナウイルスを特異的に認識する光反応性抗体を合成し、同手法がこれらのさまざまな病原体に適応できるかどうかを確かめた。その結果、用いられた光反応性抗体の特異性に応じて、選択的に排除されることが確認された。
標的特異的結合能に依存するため中和抗体である必要なし、実用化に期待
開発した手法による効果は、用いられる抗体の標的特異的結合能に依存し、中和抗体である必要はなかった。標的に結合する抗体があれば、さまざまな病原体に対する抗病原体作用を発揮することが可能なシステムといえる。「臨床上問題となる多剤耐性病原体を標的とした抗体化合物の新規合成によって、既存の治療法で制御困難な病原体に対する新たな治療法の選択肢となり得る可能性があり、今後の実用化が期待される」と、研究グループは述べている。
▼関連リンク
・東京慈恵会医科大学 プレスリリース



