がん細胞からのDAMP放出をトポテカンが誘導することを先行研究で発見、機序不明
北海道大学は7月4日、抗がん剤のトポテカンが新規の標的タンパク質であるRPL15を阻害することにより、がん免疫の活性化を促進することを明らかにしたと発表した。この研究は、同大大学院薬学研究院の鍛代悠一助教、松田正教授らの研究グループによるもの。研究成果は、「Journal of Immunology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
免疫はウイルスや細菌などの病原体を排除して生体を防御するシステムであるが、がん細胞に対しても同様に免疫細胞による攻撃が誘導されることが知られている。例えば、免疫細胞の一種である細胞傷害性T細胞はがん細胞を攻撃するが、この細胞傷害性T細胞を抗PD-1抗体で活性化させると、一部のがんにおいて腫瘍成長が減弱することが明らかとなっている。この抗PD-1抗体はニボルマブとして、非小細胞肺がんやメラノーマなどさまざまながんの治療にすでに使われている。しかし、その治療効果には個人差が大きいことが知られている。その原因として、腫瘍内に存在する免疫細胞の組成や活性化状態などの腫瘍内微小環境の違いが非常に重要であると考えられている。
がんに対する抗がん剤治療や放射線治療を行なった際の、腫瘍内微小環境に影響を与える要因の一つとしてDAMP(Damage-associated molecular pattern、ダメージ関連分子パターン)が知られている。DAMPは化学物質や放射線などさまざまなストレスを受けた細胞から放出されるDNAやタンパク質の一種で、免疫細胞を活性化する能力を持っている。そのため、がん細胞からのDAMPの放出は腫瘍内に存在する免疫細胞の機能や組成に影響を与えることで、がん免疫療法をはじめとするがんの治療効果に関与すると考えられている。
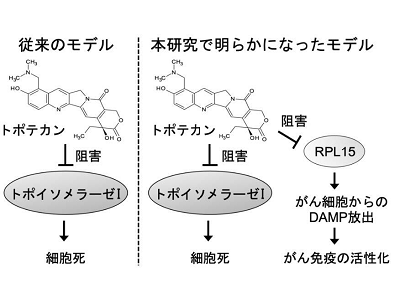
これまでに研究グループは、抗がん剤のトポテカン(ノギテカン)が、がん細胞からのDAMP放出を誘導することでがん免疫の活性化を促進することを明らかにしていた。しかし、どのようなメカニズムでトポテカンががん細胞からのDAMP放出を誘導するのかについては不明だった。そこで今回の研究は、トポテカンがDAMP放出を誘導するメカニズムを解明することと、がん細胞からのDAMP放出を介したがん微小環境の変化が抗PD-1抗体の抗腫瘍効果に影響を与えるかを検証することを目的とした。
トポテカンの新規結合タンパク質RPL15を同定、結合によりRPL15機能阻害、DAMP放出を促進
トポテカンの既知の標的であるトポイソメラーゼ I(TOP1)を欠損したMCF7細胞をCas-CRISPR法により作成し、TOP1のDAMP放出への寄与を検証した。TOP1欠損MCF7細胞トポテカンによるDAMPの放出が誘導されたため、トポテカンはTOP1とは異なる未知の標的タンパク質を介してDAMPの放出を促進することが示された。
続いて、DAMP放出に関わる未知のトポテカン標的タンパク質を同定するため、トポテカン結合ビーズを作成して細胞抽出液と混合し、トポテカン結合タンパクを質量分析により解析した。その結果、リボソームS60サブユニット構成タンパク質である「RPL15」を新規トポテカン結合タンパク質として同定した。さらにRPL15をノックダウンしたMCF7細胞ではDAMPの放出が誘導されたことから、トポテカンはRPL15に結合してその機能を阻害することでがん細胞からのDAMP放出を促進することが示唆された。
RPL15阻害メラノーマ腫瘍で細胞傷害性T細胞が増加、抗PD-1抗体による腫瘍抑制効果
次にRPL15をノックダウンしたB16-F10細胞(マウスのメラノーマ細胞)をC57BL/6マウスに移植し、腫瘍浸潤免疫細胞の解析と抗PD-1抗体に対する感受性を評価した。その結果、RPL15をノックダウンしたB16-F10腫瘍は対照と比較して有意に腫瘍成長が低下した。また対照のB16-F10腫瘍は抗PD-1抗体による腫瘍抑制効果を確認できなかったが、RPL15をノックダウンしたB16-F10腫瘍では抗PD-1抗体によって腫瘍成長が有意に低下した。
さらに腫瘍内に浸潤した免疫細胞をフローサイトメトリーにより解析した結果、RPL15をノックダウンしたB16-F10腫瘍では細胞傷害性T細胞が有意に増加し、逆にがん免疫を抑制する制御性T細胞が低下していた。
これらの結果から、RPL15の阻害はがん微小環境を細胞傷害性T細胞による細胞障害が誘導されやすい環境へ変化させるとともに、抗PD-1抗体による抗腫瘍効果を増大させることが示唆された。
RPL15特異的な阻害薬開発によるがん免疫療法の改良に期待
今回の研究で、トポテカンの新規標的タンパク質としてRPL15を同定し、トポテカンがRPL15を阻害することでがん細胞からのDAMP放出を促進することを明らかにした。さらに抗PD-1抗体に対して抵抗性であったメラノーマ腫瘍がRPL15の機能を阻害することで感受性に変化することをマウスの腫瘍移植モデルで明らかにした。「TOP1には作用しないRPL15特異的な阻害剤が開発できれば、抗PD-1抗体などのがん免疫療法の改良に貢献することが期待できる」と、研究グループは述べている。
▼関連リンク
・北海道大学 プレスリリース



