潜在的な感染伝播を防ぐため、専門家不要・低侵襲・迅速なスクリーニング法が求められている
東京大学は7月1日、従来の注射針を用いた採血に代えて、皮膚に貼るだけで抗体検出ができる、多孔質マイクロニードルとイムノクロマトアッセイを組み合わせた新しいパッチ型抗体検出デバイス(Porous MicroNeedle and ImmunoAssay:PMNIA)を開発したと発表した。この研究は、同大生産技術研究所の金 範埈教授、大学院工学系研究科精密工学専攻の鮑 蕾蕾大学院生らの研究グループによるもの。研究成果は「Scientific Reports」誌にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)のワクチンは、感染リスクとウイルス伝播の低減に有効ではあるものの、多くの低所得国では予防接種を完了した人口の割合は依然として10%未満にとどまっている。そのため、新型コロナウイルス感染症(COVID-19)の感染者を特定し潜在的な感染の広がりを防ぐことが、最も困難な課題の1つとなっている。
COVID-19診断方法として、リアルタイム逆転写ポリメラーゼ連鎖反応(RT-PCR)が現在主に用いられる検出方法であるが、設備の整った実験室および検体採取の十分な訓練を受けた医療従事者が必要である上、検出に時間がかかるという欠点がある。そのため、イムノクロマトアッセイによる抗SARS-CoV-2免疫グロブリンM(IgM)および免疫グロブリンG(IgG)抗体迅速診断法が検出時間短縮方法として開発された。SARS-CoV-2に特異的な抗体は、無症状感染者だけでなく濃厚接触者からも検出できるため、抗体検査はRT-PCR検査を補うものとして有用であるとされる。しかし、検査のためのランセットや注射針による採血が痛みを伴うほか、針による感染の危険性があるといった問題がある。そのため、専門家が不要かつ低侵襲(無痛)で簡単に使用できるSARS-CoV-2感染の迅速なスクリーニングの新しい手法が求められている。
多孔質マイクロニードル+イムノクロマトバイオセンサーで、皮下の細胞間質液に存在の抗体を検出
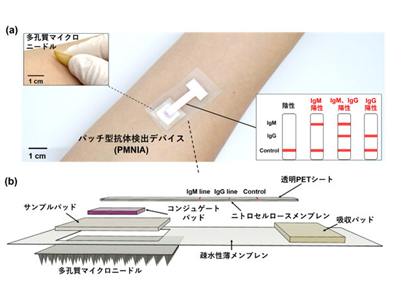
今回の研究では、血液の代わりに、皮下の細胞間質液に着目し、細胞間質液に存在する抗SARS-CoV-2 IgMおよびIgG抗体により抗体検出が行えることを初めて示した。また、生分解性ポリマー製多孔質マイクロニードルの新たな作製方法を提案し、センサーと組み合わせることで、パッチ型抗体検出デバイスを初めて実現した。提案されたデバイスは、生分解性多孔質マイクロニードルと、金コロイドナノ粒子を用いたイムノクロマトバイオセンサーで構成されている。
開発したデバイスPMNIAの原理は以下である。多孔質マイクロニードルが皮膚に刺さると、毛細管現象により、連続した微細孔を通して細胞間質液が採取されセンサーに運ばれる。その後、採取された細胞間質液はサンプルパッドに吸収され、サンプルパッドの上部に位置するコンジュゲートパッドに垂直方向に移動する。細胞間質液中に抗SARS-CoV-2 IgMおよびIgG抗体が存在する場合、コンジュゲートパッド上のSARS-CoV-2スパイクタンパク質受容体結合ドメイン標識金コロイドナノ粒子に結合し、抗原-抗体結合体となる。ニトロセルロースメンブレンを通過する間に、IgM結合体はIgMラインに配置された抗ヒトIgM抗体によって捕捉され、IgG結合体はIgGラインに配置された抗ヒトIgG抗体によって捕捉される。抗体が捕捉されると色のついた線で表示されるため目視で読み取ることが可能となる。採取した細胞間質液にSARS-CoV-2に対する特異的抗体が含まれていない場合、結合体は形成されないため、色は変化しない。デバイスの動作保証のために、ウサギIgG抗体によるコントロールラインを同様にして設ける。コントロールラインが着色することで正常動作を確認できる。結果として、目視で明確に検出結果を判定することができるという。
このデバイスの製作方法としては、まず生体分解性のポリ乳酸(PLA)を使用しマイクロニードルを製作した。PLAの微小球状粒子をエマルジョン中に分散させた溶液を用いて、球と球の隙間を使い連続した微細空孔を形成することで多孔質構造を形成し、熱処理により微小球状粒子同士を結合させ、多孔質マイクロニードルとして成形した。その後の動物実験により、ラットの皮膚から細胞間質液を迅速に抽出できることと、マイクロニードルを除去した後で速やかに皮膚が元の状態に回復したことを確認した。また、マイクロニードルとイムノクロマトアッセイを組み合わせた実験により、採取した細胞間質液がセンサーに導入され、特異抗体を目視判定できることが確認された。実験では、抗SARS-CoV-2 IgMおよびIgG抗体が試験管内で3分以内に同時に検出されたことに加え、IgMおよびIgGの検出限界はそれぞれ3および7 ng/mLであることが確認された。
低侵襲でシンプルなデバイス、今後さまざまな感染症の応用にも期待
今回の研究で提案されたパッチ型抗体検出デバイスは、既存のキットに比べ小型であり、大量に使用する際に有利であるという。提案デバイスは低侵襲かつシンプルであり、SARS-CoV-2以外にもさまざまな感染症の迅速なスクリーニングへの応用に大きな可能性を持つことから、今後も医療資源の乏しい国や地域で、他の診断検査の有効な補完手段として広く利用されることが期待できる。「多孔質マイクロニードルの作製方法は、将来的にさまざまな感染症の生体モニタリングを可能にするセンサパッチを開発するにあたり、非常に有効な要素技術となることが期待される」と、研究グループは述べている。
▼関連リンク
・東京大学生産技術研究所 プレスリリース



