受精後の3日間に起こる遺伝子発現、ヒトでの研究が可能な細胞モデルが必要だった
千葉大学は7月1日、ヒトES細胞よりもさらに受精卵に近い段階の細胞モデルの作製に取り組み、ヒトES細胞にDUX4という遺伝子を一時的に発現させることで、8細胞期胚に似た細胞集団を誘導し、細胞表面蛋白に対する抗体を用いてこれらの細胞を効率良く回収することに成功したと発表した。この研究は、同大国際高等研究基幹・大学院医学研究院の吉原正仁准教授、カロリンスカ研究所(スウェーデン)、ヘルシンキ大学(フィンランド)からなる共同研究グループによるもの。これらの細胞は誘導割球(induced blastomere:iBM)細胞と名付けられ、研究成果は「Stem Cell Reports」誌にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
生命は1つの受精卵から始まり、細胞分裂に伴い、細胞ごとに適切な遺伝子が適切な段階で活性化されて細胞が分化することでさまざまな組織や臓器が形成される。受精直後の最初の遺伝子発現である、胚性ゲノム活性化(embryonic genome activation:EGA)は、あらゆる細胞に分化する能力の獲得・維持に非常に重要な段階である。EGAが適切に起こらないと、正常な発生が停止してしまうと考えられ、EGAの詳細を明らかにすることで、不妊の原因究明や体外受精の成功率の向上につながることが期待される。
研究グループは以前、ヒト初期胚を用いて、一細胞レベルで網羅的に遺伝子の発現量を定量するシングルセルトランスクリプトーム解析により、多くのEGA遺伝子を同定した。これらの遺伝子は分化能の獲得・維持に関与することが示唆され、再生医療研究への応用も期待されているが、その多くは詳細な機能が分かっていない。ヒトでは受精後2~3日で、4細胞期から8細胞期にかけてEGAが起こるが、EGAは動物種によって起こる時期が異なるため、動物モデルをヒトEGAの研究に使用するのは困難だった。また、多能性幹細胞であるES細胞・iPS細胞は発生モデルとして広く用いられているが、これらは受精後5日目以降の発生段階に相当し、EGAの研究モデルには適していない。従って、EGA遺伝子の機能を解明するには、ヒト初期胚そのものを使う必要があり、研究のために新たな受精卵を作り破壊することになるため、倫理的な問題を伴う。近年、研究グループはDUX4という転写因子がEGA遺伝子の発現を促進することを報告した。そこで今回、DUX4を用いてヒトES細胞のEGA遺伝子を活性化し、より受精卵に近い段階の細胞モデルを作製することを目指した。
DUX4遺伝子を短時間発現させることで、受精後3日目の8細胞期胚様の性質獲得に成功
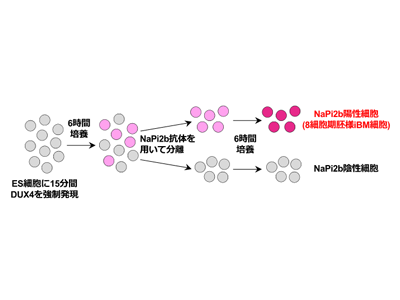
しかし、DUX4はEGAに重要な役割を担う一方で、細胞毒性を持つことが知られている。顔面肩甲上腕型筋ジストロフィー患者では、筋細胞に異所性に発現することで細胞死を引き起こす。実際、DUX4をヒトES細胞に長時間発現させると、数時間後には多くの細胞が死んでしまうため、細胞モデルとして研究に使用することは出来ない。そこで、研究グループはヒト初期胚におけるDUX4の発現が一過性であることに着目し、15分間のみDUX4をES細胞に発現させることで、多くの細胞が生存し、増殖することを確認した。短時間のDUX4発現では、DUX4が活性化するべきEGA遺伝子が十分に活性化されないことも懸念されたが、長時間発現させた時と同等に活性化されていることが確認された。
受精卵を含め、全ての細胞は同じ遺伝子情報を持っているが、細胞種ごとに異なる遺伝子のセットが発現している。特に初期発生段階では短期間で劇的に遺伝子の発現パターンが変化するため、発現パターンを調べることで、その細胞の発生段階を推測することができる。そこで、研究グループは、ヒト初期胚に発現している遺伝子を網羅的に解析したシングルセルトランスクリプトームのデータと、15分間のみDUX4を発現させたES細胞のシングルセルトランスクリプトームのデータを比較し、それらの類似性を確認した。すると、DUX4を発現させたES細胞の一部の細胞集団が、受精後3日目の8細胞期胚に特異的に発現する遺伝子を多く発現し、8細胞期胚と類似した遺伝子発現パターンを示していた。これはつまり、ES細胞に特徴的な遺伝子の発現が減少し、8細胞期胚に特徴的な遺伝子の発現が増加したことで、元のES細胞の性質が失われ、8細胞期胚様の性質を獲得したと考えられる。iBM細胞と名付けられたこれらの細胞は、DUX4を強制発現させてから12時間後の細胞に多く認められた。
しかし、DUX4を強制発現したES細胞の一部のみが8細胞期胚に類似していたため、細胞モデルとして使用するには、これらの細胞を生きたままの状態で、効率良く回収する必要がある。そこで、研究グループはFACSによるiBM細胞の単離を目指した。FACSは細胞表面に存在するタンパク質に対する抗体を用いて、さまざまな細胞から構成される集団から、特定の集団の細胞のみを生きたまま単離する技術である。研究グループは、iBM細胞に特異的に発現する細胞表面タンパク質として、SLC34A2(NaPi2b)を同定した。DUX4強制発現後12時間でiBM細胞が多く認められたことから、強制発現後6時間後の細胞を、抗NaPi2b抗体を用いたFACSにより分離し、さらに6時間培養した。すると、NaPi2b陽性細胞は、NaPi2b陰性細胞やFACSによる分離前の細胞と比較し、8細胞期胚に近い遺伝子発現パターンを示していた。このことから、抗NaPi2b抗体を用いて、効率良くiBM細胞を回収できることが分かった。
生殖医療の発展だけでなく、再生医療研究の発展に繋がることにも期待できる
ヒトのEGA遺伝子の詳細な機能は、これまで適切な細胞モデルが存在しなかったため、長らく不明だった。しかし今回の研究で作製されたiBM細胞を使用し、ゲノム編集技術などを応用することで、これらの遺伝子の機能解明が可能となると考えられる。EGAは正常な胚発生が起こるための重要な鍵であり、EGAが適切に起こらないことで初期胚が死に至るとも考えられている。「EGA遺伝子の機能解明により、ヒトの正常な初期発生過程のメカニズムを理解することで、不妊の原因究明や体外受精の成功率の向上などの生殖医療の発展だけでなく、分化能の獲得・維持機構の解明により再生医療研究の発展にもつながることが期待される」と、研究グループは述べている。
▼関連リンク
・千葉大学 ニュース・イベント情報



