シークエンス技術の発達で、染色体規模での大規模な構造変化も捉えることが可能に
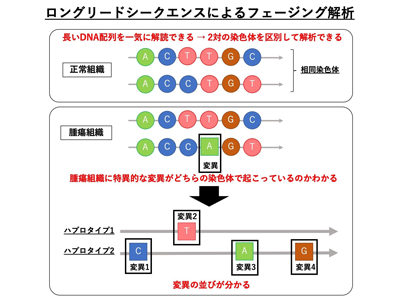
東京大学は6月21日、ショートリードシークエンス技術とロングリードシークエンス技術を組み合わせて肺がんゲノムのフェージング解析を行い、相同染色体のうち、一方の染色体に特異的に変異が蓄積している領域を見出したと発表した。この研究は、同大大学院新領域創成科学研究科の鈴木穣教授ら、国立がん研究センター、国立国際医療研究センターとの共同研究グループによるもの。研究成果は「Nature Communications」誌に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
近年、シークエンス技術の発達により、がん細胞中の遺伝子全体(ゲノム)の解析が急速に進んでいる。一塩基変異のような点突然変異に加えて、染色体規模での構造変化を伴う構造変異に対する注目度が上がってきている。この背景には、従来法に比べて100倍以上も塩基配列を長く解析することができるナノポアシークエンサーの存在がある。塩基配列を長く解読することが可能になったことで、大規模な構造変化やその染色体背景を直接捉えることができるようになった。
複雑な構造変化、それに伴う遺伝子発現制御異常が染色体ごとに明らかに
研究グループは、構造変異を含む突然変異の蓄積様式とそれらが生じている染色体背景に関して明らかにするために、従来のショートリードシークエンサーとナノポアシークエンサーを活用したフェージング解析手法を実施した。この新規の手法を用いれば、がん組織に特異的な変異がどちらの染色体で起こっているのかを捉えることができ、比較的大規模なゲノム異常とその染色体背景の特徴づけを直接的に行うことが可能だという。この新しい解析手法を肺がんゲノムの解析に用いた結果、これまでの解析手法では見出すのが困難であった、点突然変異から非常に複雑な構造変化を伴う変異を含むゲノムの異常とその染色体背景を明らかにした。
例えば、遺伝子発現制御を担うゲノム領域に検出された点突然変異が、遺伝子発現に及ぼす影響をおのおのの染色体ごとに評価することができた。実際に、点突然変異が存在するハプロタイプでは遺伝子発現が亢進している例がみられた。また、この遺伝子周辺領域のDNAメチル化パターンも解析してみたところ、点突然変異が存在するハプロタイプではDNAが低メチル化状態になっており、もう一方の染色体では高メチル化状態になっている領域があった。このような解析により、点突然変異と、遺伝子発現やその制御異常の関係性を染色体ごとに明らかにすることができるという。
これまでの知見と組み合わせ、突然変異の発生や蓄積のメカニズムを追うことも
加えて、研究ではハプロタイプ特異的な点突然変異と構造変異が密集して生じている領域を同定した。これは、クロモスリプシス(chromothripsis)と呼ばれるDNAの異常に特徴がよく似ており、詳細に解析を行った。この領域では、構造変異は複雑な構造をとっており、chromothripsisに付随して起こると言われている点突然変異が多数生じていることが判明した。また、変異が蓄積しているハプロタイプでは、他方に比べて、DNAが低メチル化状態になっていることがわかった。また、その領域内にコードされている遺伝子の発現も調べてみたところ、点変異、構造変異が蓄積しているハプロタイプで遺伝子の発現が亢進していることが判明した。これらは、がん特異的なゲノム変異と、遺伝子発現の総体であるトランスクリプトーム、それらの制御を担うエピゲノムの異常を統合して、ハプロタイプ別に解析した例として大変意義深いものだという。
この他にも、同一リード上に載っている複数の点突然変異や構造変異を調べることで、その時系列を追うことも可能になった。これらのことから、既知の知識と今回の手法で判明したような新たな知見を組み合わせることで、がん細胞のゲノム内の突然変異の発生・蓄積のメカニズムを追うことが可能であるという。「将来的には、個々の患者さんのがんの発症から進展様式までを追うことができるようになると考えられ、より個々の患者さんの病態に焦点を当てた治療戦略の選択や、新たな治療法の開発にもつながると考えている」と、研究グループは述べている。
▼関連リンク
・東京大学大学院新領域創成科学研究科 記者発表




