サイトカイン放出症候群に起因する凝固障害は、CAR-T療法の課題となっている
京都大学は6月20日、キメラ抗原受容体T細胞(CAR-T)療法として、チサゲンレクルユーセル(tisagenlecleucel、tisa-cel)を投与されたびまん性大細胞型B細胞リンパ腫(DLBCL)25例を対象に、リンパ球除去化学療法前、CAR-T細胞投与3日後、13日後での凝固線溶系マーカーの変動を解析し、サイトカイン放出症候群(CRS)発症初期においては、PAI-1上昇による線溶抑制と、それによる相対的な凝固亢進状態にあり、血栓の本体となるフィブリンの生成が増加していることがわかったと発表した。この研究は、医学部附属病院の山﨑真紀子臨床検査技師、新井康之助教と、同大医学研究科の髙折晃史教授、足立壯一教授、奈良県立医科大学小児科、株式会社LSIメディエンスらの共同研究グループによるもの。研究成果は「Blood Advances」誌にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
CAR-T療法は、難治性急性リンパ性白血病や、難治性悪性リンパ腫などの患者さんを対象とした治療法の一つである。CAR-T療法は、がん細胞に対する特異性が高く、長期間CAR-T細胞が体内に維持されるという長所を持つ反面、免疫反応によるCRSや神経毒性をはじめとした治療毒性が現在の課題となっている。なかでもCRS関連凝固障害は、CAR-T細胞投与によって放出される大量の炎症性サイトカインにより、もともとは血栓形成を防ぐ作用を持つ血管内皮細胞が傷害を受けることで、血栓症や消費性凝固障害が引き起こされるといわれているが、いまだ原因や病態がはっきりとは解明されていない。また、重度のCRSを合併した急性リンパ性白血病(ALL)においては、CRS関連凝固障害が著明に見られるが、DLBCLにおいては凝固障害の頻度や程度はいまだ不明な点が多かった。
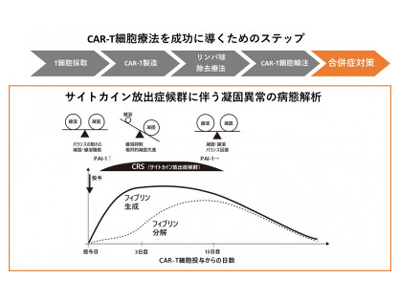
DLBCLでも、通常検査値異常に現れない凝固異常が起こっていることが明らかに
研究グループは、CAR-T療法の一つであるチサゲンレクルユーセル(tisa-cel)を投与されたDLBCLの25例を対象に、リンパ球除去化学療法前、tisa-cel投与3日後、13日後の凝固線溶マーカーの変化を解析した。投与後、25例中1例を除き軽度のCRSを合併したが、解析の結果、リンパ球除去前と比較し、CRS発症初期(3日後)においては、炎症マーカーに加えて、線溶抑制マーカーであるPAI-1(total PAI-1)が約2倍という有意な上昇を示した。また、凝固活性化マーカーも上昇を認めたことから、CRS発症初期においては、PAI-1上昇による線溶抑制と、それによる相対的過凝固状態にあることがわかった。CRSが沈静化した投与13日後には、totalPAI-1もリンパ球除去化学療法前の値まで低下し、線溶抑制状態は解消したことが示唆された。
研究グループは、一連の反応の端緒となったPAI-1は、CRSに伴い血管内皮細胞から放出されたと推測している。また今回の研究では、不明な点が多かったDLBCLにおいても、通常検査値異常に現れない凝固異常が確実に起こっていることが示された。同時に、本コホートにおいては、血管内皮障害や血栓症の明らかな発症は認めず、新鮮凍結血漿投与などの治療による影響を受けないCRS関連凝固異常の自然史を観察できたと考えられるという。
本研究によって、重度のCRSだけではなく、軽度のCRSにおいても、確実に凝固異常が起こっていることが示された。また、多数の凝固線溶マーカーを測定することにより、CRS期間中の凝固線溶マーカーの動きも捉えることができた。「研究結果は、CRS関連凝固障害の原因や病態解明の一助となることが期待される」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る



