新型コロナウイルスと、SARSやMERSの感染機構の違いは明らかになっていなかった
東京大学医科学研究所は6月16日、膜融合への関与が既に知られていたセリンプロテアーゼやシステインプロテアーゼに依存しない、新たな新型コロナウイルスの感染経路を発見したと発表した。この研究は、同研究所附属アジア感染症研究拠点の山本瑞生特任講師、合田仁特任准教授、東京大学の井上純一郎名誉教授・特命教授らの研究グループによるもの。研究成果は「mBio」誌にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
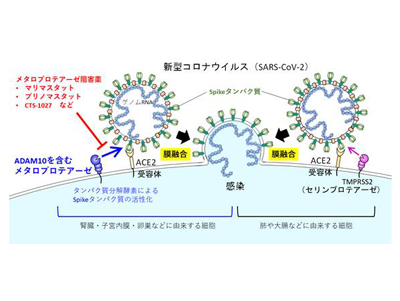
新型コロナウイルス感染症(COVID-19)では、呼吸器だけでなく血管・腎臓・脳などさまざまな組織へのウイルス感染がその複雑な病態に関与していると考えられる。新型コロナウイルスが細胞に感染するためにはウイルス外膜と細胞の膜(細胞膜やエンドソーム膜)を融合させてウイルス遺伝子を細胞内へ侵入させる必要がある。それにはウイルス外膜のSpikeタンパク質が細胞膜上の受容体ACE2に結合し、その後にSpikeタンパク質が細胞に発現するタンパク質分解酵素(プロテアーゼ)によって部分的に切断され活性化することが重要である。
これまでに細胞膜上に発現するセリンプロテアーゼTMPRSS2やエンドソーム内に発現するシステインプロテアーゼCathepsin B/LによるSpikeタンパク質の切断・活性化が報告されていたが、他のプロテアーゼの関与は報告されておらず、過去に局地的に感染が広がったSARSやMERSコロナウイルスと今回全世界的に感染拡大している新型コロナウイルスの感染機構における違いは明らかになっていなかった。
約3,000種類の化合物スクリーニングから、メタロプロテアーゼの関与を見出す
研究グループは、以前の研究でウイルス外膜と細胞膜の融合を評価する膜融合アッセイ系を用いてナファモスタット(フサン)などの感染阻害薬を同定していた。今回まず、このアッセイ系を用いて、新型コロナウイルスのSpikeタンパク質がSARSやMERSコロナウイルスのSpikeタンパク質とは異なり、TMPRSS2非依存性に膜融合を誘導することを発見した。
そこで、既存薬・分子標的薬など約3,000種類の化合物ライブラリーを用いたスクリーニングを行い、イロマスタット、CTS-1027といった広範なメタロプロテアーゼに対する阻害薬がTMPRSS2非依存性の膜融合を効果的に阻害することを見出し、何らかのメタロプロテアーゼがこの膜融合に重要であることを明らかにした。
メタロプロテアーゼはMMP(Matrix metalloproteinase)やADAM(a disintegrin and metalloproteinase)ファミリーなどを含むタンパク質分解酵素の総称であり、これまでに固形がんの転移や浸潤等への関与が示されてきた。これまでに、がん転移や浸潤の阻害を目的としてマリマスタットやプリノマスタットというメタロプロテアーゼ阻害薬の臨床試験が行われ、これらの体内投与における一定の安全性が確認されている。研究グループは、これらのメタロプロテアーゼ阻害薬について新型コロナウイルスのSpikeタンパク質による膜融合への阻害効果を検討したところ、TMPRSS2非依存性の膜融合を特異的に阻害することがわかった。
次に、このメタロプロテアーゼ依存性の膜融合がどのような組織由来の細胞で感染に重要かを調べるためにSpikeタンパク質を発現するシュードウイルスを用いてさまざまな細胞株におけるマリマスタットの感染阻害効果を解析した。その結果、マリマスタットは腎臓や子宮内膜および卵巣由来の細胞株においてシュードウイルスの感染を効果的に抑制したが、肺や大腸由来の細胞株では抑制効果を示さなかった。これにより、メタロプロテアーゼによる新型コロナウイルス感染には細胞特異性があることがわかった。
メタロプロテアーゼを利用し感染するために必要なドメインを発見
さらに研究グループは、高病原性コロナウイルスの中で新型コロナウイルスのSpikeタンパク質のみがメタロプロテアーゼを利用できる機構を調べた。Spikeタンパク質の構造が類似しているにもかかわらずメタロプロテアーゼを利用した感染を起こせないSARSコロナウイルスのSpikeタンパク質と部分的に構造を入れ替えたキメラSpikeタンパク質をもつシュードウイルスを作成して比較した。
その結果、メタロプロテアーゼを利用して感染するためには、Spikeタンパク質がS1とS2の2つのドメインの境界にFurinというタンパク質分解酵素に切断される新型コロナウイルス由来の配列を持つこと、新型コロナウイルスのSpikeタンパク質のC末端側のS2ドメインを持つこと、の両方が必要なことを見出した。また、標的細胞側の因子を同定するため、特異的な阻害薬や遺伝子ノックダウン法を用いて解析を行い、細胞膜上で働くADAM10というメタロプロテアーゼが重要な働きを持つことを明らかにした。
新たな感染機構を獲得したことが、全世界的なパンデミックを引き起こした可能性
さらに、臨床応用が期待されるマリマスタットやプリノマスタットが、過去の臨床試験で用いられた血中濃度以下の濃度で、新型コロナウイルス感染に依存した細胞融合や細胞死を抑制することも見出した。細胞融合や細胞死はCOVID-19のさまざまな病態に関わる可能性があり、メタロプロテアーゼの治療標的としての重要性を示唆している。
今回の研究から、局地的な感染拡大に留まったSARSやMERSコロナウイルスとは異なり、新型コロナウイルスはSpike遺伝子に複数の特徴を持つことでADAM10を含むメタロプロテアーゼを利用した感染機構を獲得、全世界的なパンデミックを起こし複雑な病態を誘導するように進化した可能性が示唆されたという。「本研究の成果は新型コロナウイルスの感染拡大の機構やさまざまな組織に感染し障害を起こすCOVID-19の複雑な病態の解明に繋がるだけでなく、重症化や後遺症などのさまざまな病態に対する治療法の開発や新たな変異株の病原性の予測に役立つことが期待される」と研究グループは述べている。
▼関連リンク
・東京大学医科学研究所 プレスリリース



