腫瘍微小環境では、なぜ炎症ががん免疫の活性化につながらないのか?
京都大学は6月8日、免疫チェックポイント阻害薬(抗PD-1抗体など)非感受性LLC1肺がんモデル動物において生理活性脂質プロスタグランジンE2(PGE2)が受容体EP2・EP4を介して、炎症反応・血管新生および制御性T細胞(Treg)のリクルート・活性化を促進するという作用機序を明らかにしたと発表した。この研究は、同大医学研究科の成宮周特任教授(名誉教授)、タムケオ・ディーン特定准教授、パンヤワタナヌクーン・シワコン博士課程学生らの研究グループによるもの。研究成果は、「Cell Reports」のオンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
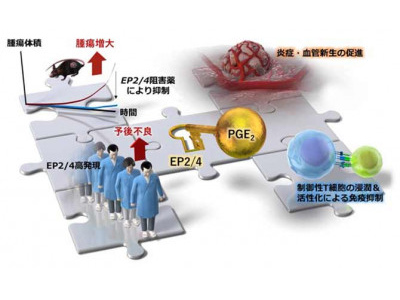
プロスタグランジン(PG)は、不飽和脂肪酸であるアラキドン酸の代謝物で、外傷や感染など侵害刺激が生体に加わって生じる腫脹や熱感、痛み、発熱などの急性炎症症状の発現に関わっている。一般的には、炎症に続き免疫細胞が活性化し、それによって免疫反応が惹起される。炎症は本来刺激が無くなると終息するが、往々にして長引く。例えば、がんにおいては、炎症が長期にわたり持続することが知られている。それにもかかわらず、炎症に続く免疫反応が抑制され、がんの進行に寄与すると考えられている。なぜ腫瘍微小環境では、活発な炎症が免疫の活性化につながらないかは大きな謎だった。
抗PD-1抗体非感受性肺がんマウスでPG受容体EP2/4阻害の効果と仕組みを解析
がん治療における免疫チェックポイント阻害薬の成功は、腫瘍微小環境での免疫回避・腫瘍増殖促進メカニズムを研究することが、がん細胞そのものの研究と同様、非常に重要であることを改めて示した。一方、現今の免疫チェックポイント阻害薬の一つの課題は、有効性のあるがんでも奏功率が30%程度にとどまり、無効ながん種も多いことだ。このため、免疫チェックポイント阻害薬の有効性を向上させる手段、あるいは、CTLA-4やPD-1以外の免疫抑制分子についての研究開発が活発に行われている。
研究グループは今回、免疫チェックポイント阻害薬である抗PD-1抗体が無効なLLC1肺がんの同種移植マウスモデルを用いて、EP2/4阻害薬による抗腫瘍効果およびそのメカニズム解明に向けた研究を実施した。
EP2/EP4阻害薬はマウス腫瘍を抑制
はじめに、LLC1腫瘍に対して、EP2/EP4阻害薬の投与が有意に腫瘍増大を抑制することを確認した。次に、EP2、EP4受容体のノックアウトマウスを用いて検討を行った。その結果、同様の腫瘍増大の抑制効果が観察され、EP2およびEP4の阻害はがん細胞そのものではなく、宿主由来の細胞を介して働いていることが示唆された。
PGは受容体を介して炎症・血管新生・Tregリクルート/活性化を促進
さらに、そのメカニズムを調べるために、LLC1担がんマウスに対してEP2/EP4阻害薬の投与を行い、腫瘍を摘出し、宿主由来の腫瘍浸潤免疫細胞をFACS sorting法により回収した後、scRNAseq法で総計3万1,971個の腫瘍浸潤免疫細胞の遺伝子発現解析を行った。遺伝子発現のパターンによりclustering解析を行い、腫瘍浸潤免疫細胞を骨髄系由来細胞やリンパ球など15の細胞集団に分類した。T細胞集団については、さらにsubclustering解析を行い、CD8T細胞、CD4Treg細胞、Treg以外のCD4T細胞、増殖T細胞の4つの亜集団に分類した。
続いて、これらの細胞集団について、それぞれでEP2/EP4阻害による遺伝子発現変化を解析した。その結果、EP2/EP4経路が、骨髄系細胞集団(TAN s1-s2、Mono s1-s4およびTAM)でNF-κB経路を活性化して炎症・血管新生関連遺伝子の発現誘導を起こしていることと、他方で、mregDC細胞(免疫制御分子に富む腫瘍内成熟樹状細胞)とCD4Treg細胞に働くことで、Tregの腫瘍へのリクルートと活性化を促進していることを見出した。
ヒトでも特定のがん種でEP2/EP4の発現量がマウスの結果と強く相関、予後と逆相関
特記すべきは、ヒトがんデータベース解析により、扁平上皮肺がん、卵巣漿液性嚢胞腺がん、浸潤性乳がんおよび肝細胞がんなどのヒトがんにおいて、EP2/EP4 の発現量が上記2つの過程(骨髄系細胞による炎症・血管新生およびTregによる免疫抑制)に関連する遺伝子の発現と相関し、これらがんの予後予測因子となりうることを見出した点である。これらの結果は、PGE2-EP2/EP4シグナルが骨髄系細胞での炎症の活性化とTreg細胞を介する免疫抑制という2つの相反する現象に作用していることを示唆するもので、新しい概念だ。
臨床試験が進むEP2/EP4阻害薬、適応がん患者の特定につながる可能性
今回の研究により、PG合成阻害薬であるアスピリンの疫学的研究で長年示唆されてきたPGのがんにおける役割の実態と分子メカニズムの一端を明らかにしたことは、学術的に非常に意義があると考えられる。また、最近、EP2/EP4阻害薬はさまざまながん患者に対する臨床試験に進んでいるが、研究成果により、この薬物の対象とする患者の選別、層別化に大きな影響を及ぼす可能性があり、臨床試験の加速につながることが期待される。
「研究でLLC1がんモデルの解析で一定の成果は得られたが、LLC1がんモデルはT細胞浸潤が少なく、抗PD-1抗体も無効な腫瘍であるため、多くのT細胞が浸潤する腫瘍微小環境でのEP2/EP4依存性の免疫回避のメカニズムはLLC1がんモデルとは異なっている可能性が考えられる。今後はこれまでに確立した手法を用い、T細胞の浸潤が多く、抗PD-1抗体が有効ながんモデルマウスの解析を行い、これまで知られていない未知のEP2/EP4依存的な免疫回避メカニズムをさらに探索したいと考えている」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る




