生存率の悪い心不全、異なる種類の細胞間相互作用に着目した研究はほとんどなかった
東京大学医学部附属病院は6月9日、心臓にある線維芽細胞に存在するHtra3というタンパク質の働きが失われると、心臓に負担がかかった時に線維芽細胞や心筋細胞に異常が生じて心不全が悪化すること、また異常になった心筋細胞が分泌するさまざまなタンパク質のうちIGFBP7を定量評価することで心不全患者の重症度予測に役立つことを世界で初めて発見したと発表した。この研究は、同大学医学部附属病院循環器内科の候聡志特任助教、野村征太郎特任助教、山田臣太郎特任研究員、小室一成教授、奈良先端科学技術大学院大学先端科学技術研究科の岡千緒助教、東京大学先端科学技術研究センターの油谷浩幸名誉教授らの研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
近年、世界的に心不全患者は増加の一途を辿っている。さまざまな内科的・外科的治療が試みられているものの、依然として心不全患者の生存率は悪く、通常、心不全と診断されてから5年間の死亡率は約50%であると考えられている。これまでの心不全の研究では、心筋細胞など特定の種類の細胞を対象とした解析がなされてきたが、心不全の発症や進展の過程で、心臓内にある異なる種類の細胞間の相互作用に着目した研究はほとんどなかった。
線維芽細胞のHtra3、TGF-βを分解し心不全を抑える役割が判明
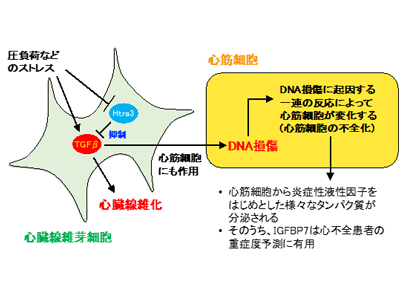
研究グループは、シングルセル解析(Single-cell RNA sequencing)法を用いてマウス心臓内に存在するさまざまな細胞集団の網羅的遺伝子発現解析を行った。その結果、特に心臓線維芽細胞と心筋細胞間でシグナルのやり取りが多いことがわかり、心臓のポンプ機能を司る心筋細胞は線維芽細胞から影響を受けていると考えられた。そこで心臓線維芽細胞の遺伝子発現解析から、機能未知の遺伝子であるHtra3を見出し、そのノックアウトマウスを作成して解析した結果、Htra3 の働きがなくなることで、圧負荷や心筋梗塞など、さまざまな負荷が心臓に加わった時に重症の心不全に陥ることがわかった。
そのメカニズムとして、Htra3の働きが失われることにより、本来Htra3によって分解されるはずのTGF-βタンパク質が増えることで、線維芽細胞自身がより多くの線維を作って心臓を硬くしてしまうほか、TGF-βによって心筋細胞内で誘導されるNox4タンパク質によって酸化ストレスが増してDNAが損傷されるなど、心筋細胞も間接的に影響を受けてその性質が変化することが明らかとなったという。反対にHtra3を過剰発現させてその働きを強めると、心不全改善効果があることもわかった。
心不全心筋細胞が分泌するIGFBP7、心不全重症度予測マーカーとなる可能性
さらに、心不全に際して性質が変化してしまった心筋細胞では多くの種類のタンパク質を分泌することがわかり、健常者及びさまざまな重症度の心不全患者の血清中のタンパク質の解析データを検証した結果、こうした心不全心筋細胞が分泌するタンパク質のうちで特にIGFBP7は心不全の重症度を予測する高精度なバイオマーカーとなることも明らかになった。
本研究で見出したHtra3は、それを産生する心臓線維芽細胞自身のみならず、TGF-βシグナルの調整を介して間接的に心筋細胞にも影響を与えており、心不全治療における新しい標的分子として期待されるという。また、本研究で解析した心不全患者の血清中タンパク質のうち、IGFBP7は患者の重症度の予測に有用であることがわかった。「今後はIGFBP7の働きを解明して、どのように心不全の発症や進展に関与していくのかを明らかにしていくことを目指す」と研究グループは述べている。
▼関連リンク
・東京大学医学部附属病院 プレスリリース



