重篤な合併症が引き起こされる難治性川崎病、発生機序解明が課題
岡山大学は6月7日、難治性川崎病の病態に、普段は細胞核の構成因子として存在し、炎症刺激で放出されるhigh mobility group box-1(HMGB1)と、炎症を増幅させるHMGB1の働きを抑えて血管内皮を保護するhistidine rich glycoprotein(HRG)が関わっており、川崎病の治療経過中にHRGが低下しHMGB1が上昇すると、既存治療が効きにくくなることを発見したと発表した。この研究は、同大学術研究院医歯薬学域小児医科学分野の塚原宏一教授、八代将登助教、難波貴弘大学院生と創薬研究推進室の西堀正洋特任・特命教授らの研究グループによるもの。研究成果は、「Modern Rheumatology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
川崎病は、川崎富作博士が1960年代に報告した小児特有の原因不明の病気で、ウイルスや細菌の感染を契機とした過剰な免疫反応によって全身性の血管炎が起きると考えられている。国内発症率が年々増加傾向にある川崎病において、重篤な合併症に冠動脈瘤があり、既存治療の効果が不十分な場合に、血管内の激しい炎症と血管内皮の損傷によって形成される。最新の報告では川崎病の8.3%に冠動脈瘤の発症が認められており、冠動脈瘤が詰まったり破裂したりすることで命を落とすこともあるものの、難治性川崎病の発生機序はいまだに明らかになっておらず、治療に効果がある人とあまり効果が得られない人の違いについてもわかっていなかった。
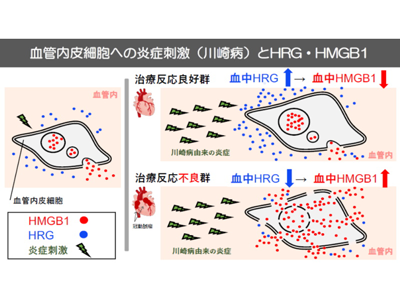
治療反応不良群では治療の前後で血液中のHRGが減少し、HMGB1が上昇
研究グループは、川崎病の主な病態は血管炎で、血管内皮の広範な障害がおこり、冠動脈病変の病理所見ではしばしば好中球浸潤が認められることから、好中球の活動性を抑えて血管内皮細胞に保護的に働く HRGと、普段は血管内皮細胞の核内に存在し炎症増幅作用を有するHMGB1が難治性川崎病の発生に関与していると考えた。研究ではまず、川崎病の患者の発症時の血液中HRGを調べ、健常対照と比較して有意に低下していることを発見した。次に、川崎病の患者を、発症から10日目までに解熱した群(治療反応良好群)と10 日目以降も発熱が持続している群(治療反応不良群)に分けて違いを調べた。その結果、治療反応不良群では治療の前後で血液中のHRGが減少し、HMGB1が上昇していることが判明した。
代表的な炎症マーカーであるCRPやその他のマーカーはいずれも川崎病の治療の前後で改善をしており、治療反応良好群と治療反応不良群の間では差を認めなかった。一方、HRGとHMGB1は治療の前後では治療反応良好群と治療反応不良群の間で傾向が逆転しており、これらの変化が難治性川崎病の病態を反映していると考えられた。
同研究グループの西堀特任・特命教授らの以前の研究で、敗血症ではHRGが血管内皮細胞障害の原因となるHMGB1の放出を抑えることが明らかになっていた。川崎病でも急性期の炎症刺激により血中にHMGB1が放出されるが、血中HRGが豊富にある場合は血管内皮細胞からのHMGB1の放出が抑えられると推定された。HRGとHMGB1は血管内皮の状態を直接的に反映しているため、血管炎が主病態である難治性川崎病の病態評価にとって有用なバイオマーカーであると考えられた。
血管炎を主病態とする難病の病態解明にも
川崎病は小児期に発症する代表的な炎症性疾患であり、HRGとHMGB1は難治性川崎病の病態に深く関与している可能性が示唆された。血管炎を主病態とする他の疾患(高安動脈炎やベーチェット病など)でも、HRGやHMGB1の関与が疑われ、難病の病態解明につながるという。「将来的には、冠動脈病変を防ぐ目的でHRGを補充する治療につながることが期待される」と研究グループは述べている。
▼関連リンク
・岡山大学 プレスリリース



