受精卵が最初に迎える運命決定について、詳細な分子メカニズムは明らかではなかった
東北大学は6月3日、ヒト胎盤の発生や分化に必須な遺伝子を同定し、その制御機構を明らかにしたと発表した。この研究は、同大大学院医学系研究科情報遺伝学分野の小林記緒助教、岡江寛明准教授、有馬隆博教授、九州大学生体防御医学研究所、東京医科歯科大学の共同研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
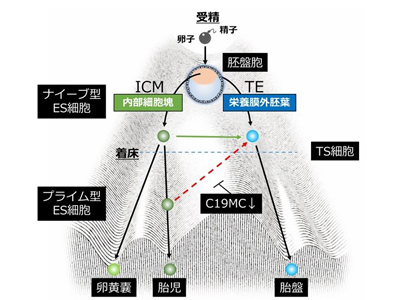
ほ乳類の受精卵は、受精後から卵割とよばれる分裂を続け、将来の胎児もしくは胎盤となる2種類の細胞に分かれる。これらの細胞は、同じ遺伝子配列をもつにも関わらず、全く異なる発生運命をたどる。これまで、ヒトをはじめとする霊長類では、この受精卵が迎える最初の運命決定について、その詳細な分子メカニズムは明らかにされていなかった。
研究グループは、これまでにヒト受精卵や初期胎盤組織から栄養膜幹(Trophoblast Stem:TS)細胞を樹立することに成功していた。このTS細胞の培養技術を利用し、発生段階の異なるナイーブ型とプライム型の2種類のヒト胚性幹(Embryonic Stem:ES)細胞をTS 細胞へ分化転換させ、その細胞特性と遺伝子発現の変化について詳細に解析した。
霊長類だけがもつC19MC遺伝子がエピジェネティック制御を受ける
研究の結果、着床前の胎児細胞に相当するナイーブ型ES細胞は、TS細胞へ分化転換したのに対して、着床後の胎児細胞に相当するプライム型ES細胞から分化転換した細胞は、TS細胞としての性質を保持していなかった。研究グループは、これらの細胞間における遺伝子発現やDNAメチル化状態を網羅的に解析し、C19MC遺伝子(Chromosome 19 microRNA cluster)の発現に顕著な違いがあることを突き止めた。C19MC遺伝子は、TS細胞やナイーブ型ES細胞で高発現し、プライム型ES細胞では100分の1倍の低発現を示していた。
さらに同研究では、ゲノム編集技術を用いてC19MC遺伝子近傍のDNAメチル化領域の欠損TS細胞を作製し、C19MC遺伝子がエピジェネティックな制御を受け、DNAメチル化によりその発現が低下することを明らかにした。このC19MC遺伝子は、霊長類だけがもつ遺伝子で、ゲノムインプリンティングを受ける遺伝子座に存在する。したがって、胎児と胎盤組織におけるインプリンティング制御の違いが細胞の運命決定に関与する可能性が示唆された。
今回の研究により、ヒト胎盤の発生に必須な分子とその制御機構が明らかになった。「研究成果は、ヒト受精卵や胎盤の発生メカニズムの基礎的研究にとどまらず、生殖補助医療や再生医療への貢献が期待できる。」と研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース・研究成果



