遺伝子導入せず、より「生理的」な骨格筋細胞を作製する技術
京都大学iPS細胞研究所(CiRA)は5月30日、遺伝子導入を用いずヒトiPS細胞から骨格筋幹細胞を誘導し、骨格筋細胞を作製する技術を開発したと発表した。この研究は、CiRA臨床応用研究部門の藤原慧特定研究員(現、大阪医療センター)、櫻井英俊准教授、大阪大学大学院医学系研究科保健学専攻の久保田智哉助教らの研究グループによるもの。研究成果は、「Frontiers in Cell and Developmental Biology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
遺伝性筋疾患において、患者由来iPS細胞を用いて病態メカニズムの解明が進み、創薬スクリーニングを実現することが、新規治療法の確立に向けて期待されている。筋疾患においては3つ組構造やサルコメア構造といった細胞内部構造に異常を来すことが多く、病態を正確に再現するためにはこういった構造を持つ「成熟した」骨格筋細胞を作製することが重要と考えられている。さらにその骨格筋細胞は実際のヒトの筋線維に近い「生理的な」細胞であることが望ましいと考えられる。これまでにも同研究グループを含めいくつかのグループが、電気刺激装置やモールドを使った3D培養法などを駆使して成熟化させることに成功しているが、特殊な器具や装置を必要とする方法であり、創薬スクリーニングへの応用にはさらなる技術革新を必要としていた。
また、従来ヒトiPS細胞から骨格筋細胞を効率よく作製する際には、特定の遺伝子を導入し分化誘導を行うことが多く用いられている。しかしながら、この方法では特定の遺伝子発現が増幅されることで不自然な遺伝子ネットワークが形成される恐れがあり、骨格筋疾患の病態解析に悪影響が出る可能性があった。研究グループはこの問題を克服するため、以前に報告した外来遺伝子の導入を行わない分化誘導法で骨格筋幹細胞(iMuSC)を誘導し、iMuSCを純化した後に再度培養することで「生理的な」骨格筋細胞を作製し、さらに病態解析に適した「成熟した」骨格筋細胞にすることを目指して研究を行った。
無血清培地を用いることで高効率に骨格筋分化
研究グループはまず、iMuSCの目印として特異的なマーカー遺伝子であるPAX7が発現すると黄緑色の蛍光を発するPax7-VenusレポーターiPS細胞を用いて、iMuSCを分化誘導し、得られたiMuSCsを用いて成熟した骨格筋細胞の誘導条件を検討した。
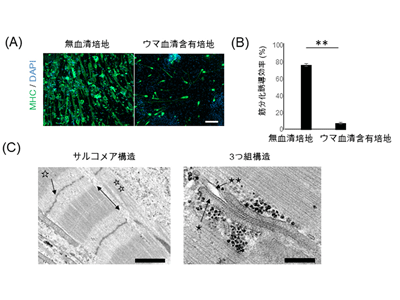
iMuSCを5日間増殖培地で十分に増殖させたのち、分化誘導培地に切り替えた。この際、無血清培地を用いると、従来使用していたウマ血清培地と比較して、筋収縮に重要な役割を果たすミオシン重鎖タンパク質(MHC)が多くみられ、高効率に骨格筋分化が進むことがわかった。さらに、培養7日目に高濃度マトリゲルを培養皿底面に重層することで細胞の成熟化を図った。その結果、培養42日目では整列したサルコメア構造、3つ組構造いずれもが電子顕微鏡で確認できた。またこれらの特徴は、他のiPS細胞株を用いて表面マーカーによる純化法でiMuSCを純化した場合にも確認された。
成熟化関連の遺伝子発現も確認
次に、高濃度マトリゲル3D重層が骨格筋の成熟化にどのような影響を及ぼしているのかを調べるため、成熟化に関連して上昇する遺伝子の発現量を解析した。種々のミオシン重鎖遺伝子(MYH2〜8)と筋小胞体関連遺伝子(CASQ1、ATP2A1)、T管関連遺伝子(DHPRα、DHPRβ、DHPRγ)の発現パターンを比較すると、培養14日では高濃度マトリゲル3D重層を行った群では、解析を行った遺伝子発現いずれもが、重層しなかった群と比較して上昇傾向にあることがわかった。またこれらの特徴は、他のiPS細胞株を用いて表面マーカーによる純化法でiMuSCを純化した場合にも確認された。
続いて、高濃度マトリゲル3D重層により作製した骨格筋細胞のナトリウムチャネルの発現、電気生理学的な性質の解析を行いました。一般的に、ナトリウムチャネルであるSCN4Aは骨格筋が成熟するにつれその発現が上がり、SCN5Aは胎児期の骨格筋、心筋に発現していることが知られている。iPS細胞から分化誘導された筋細胞において、SCN4Aの発現が上昇することは、筋細胞が胎児期から成熟化に向かっている特徴であると考えられる。この成熟化培養法を用いると、SCN4Aの発現は経時的に上昇していった。一方、SCN5Aの発現量には変化はなかった。
次に骨格筋細胞を用いてパッチクランプ法でナトリウム電流を測定した。その結果、このナトリウム電流はフグ毒として知られるナトリウムチャネル阻害剤であるテトロドトキシン(TTX)によって抑制されたことから、SCN4Aチャネルを介した電流であることが示唆された。
分化均一性を確認、筋疾患の創薬スクリーニングに有望
最後に、このiMuSCsから誘導した成熟骨格筋細胞が将来的な創薬スクリーニングに使用できるか評価を行った。96wellの細胞プレートの内側60wellにiMuSCsを培養し、骨格筋細胞に分化させ、その分化均一性を評価した。ほとんどのWellで分化誘導効率は70%後半から80%台であり平均誘導効率は約79%と高効率だった。また、正確なスクリーニングを行うためにはwell間のばらつきの指標であるCV値が10%を切ることが必要と言われているが、CV値は3.17%と非常に低い値であり、このiMuSCsから作製した成熟骨格筋細胞分化系は筋疾患に対する創薬スクリーニングにも有望であることがわかった。
今回の研究ではヒトiPS細胞から骨格筋幹細胞iMuSCsを誘導し、これを用いることで成熟した骨格筋細胞を得ることに成功した。この骨格筋細胞は細胞内収縮装置である整列したサルコメア構造、筋小胞体とT管からなる3つ組構造が存在し、さらに成熟骨格筋に特徴的なナトリウムチャネルの発現を備え、機能も評価可能だという。こうした特徴は従来法でiPS細胞から分化誘導された骨格筋細胞には見られない。さらに同研究では特定の外来遺伝子を強制発現させることなく分化を行っており、より生理的に分化させることができた。
遺伝性筋疾患のいくつかにはサルコメア構造や3つ組構造に異常を認めるという報告があり、同細胞を用いることで筋疾患の病態モデルの作製、疾患のメカニズム解析が進むと期待される。さらに、「この骨格筋細胞誘導法は高い分化効率と均一性を持ち、将来的に創薬スクリーニングを行い筋疾患に対する有効な治療標的を見つけることに貢献できると期待される」と、研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所 ニュース




