PSPへのアミロイドβ関与は否定的、PSPのタウ凝集を支配する分子は不明
名古屋大学は5月26日、アクチン結合タンパク質フィラミンAがタウの凝集を促進し、進行性核上性麻痺の病態に関与することを明らかにしたと発表した。この研究は、同大大学院医学系研究科神経内科学の勝野雅央教授、佐橋健太郎講師、辻河高陽医員(筆頭研究者)ら、国立研究開発法人日本医療研究開発機構(AMED)脳とこころの研究推進プログラム(領域横断的かつ萌芽的脳研究プロジェクト)、横浜市立大学大学院医学研究科遺伝学の松本直通教授、濱中耕平助教、愛知医科大学加齢医科学研究所の吉田眞理特命研究教授、名古屋大学大学院医学系研究科細胞生物学の宮田卓樹教授、新潟大学医学部脳研究所兼JALPACコンソーシアムの池内健教授、東京大学大学院医学系研究科神経病理学兼J-ADNIコンソーシアムの岩坪威教授などの研究グループによるもの。研究成果は、「Science Advances」(電子版)に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
進行性核上性麻痺(progressive supranuclear palsy:PSP)は、脳内の神経細胞とグリア細胞で微小管結合タンパク質タウが異常に凝集し、神経細胞死をきたす難病。その患者の多くが、発症後5年から10年で死亡する。経過中に多様な神経症状、認知症症状、精神症状をきたし、転倒や誤嚥・窒息などによる合併症を伴うことから、患者の家族に深刻な介護負担を招きやすく、解決すべき大きな社会的問題となっている。
死後脳剖検で見られる、星形のグリア細胞であるアストロサイトで房状にタウが凝集する「tufted astrocyte」が、PSPの大きな特徴だ。かつては核上性の眼球運動障害や姿勢反射障害を主徴とするRichardson症候群がPSPの神経症状とみなされていたが、死後剖検脳の知見の蓄積により、現在ではパーキンソン病や脊髄小脳変性症と診断される患者の中に、実際にはPSPである患者が含まれることが明らかになっている。そのため、PSPの有病率は人口10万人あたり約18人と考えられてきたが、実際にはそれ以上の患者数が潜在的に存在すると推測される。しかし、PSPの分子病態には不明な点が多く、病態を抑止する根本的治療はいまだ確立されていない。
タウの異常凝集を伴った神経細胞死が確認されている疾患は、アルツハイマー病が代表的であり、PSP等とともにタウオパチーと称される。アルツハイマー病では、アミロイドβがタウに凝集を促すというアミロイド仮説が知られており、現在までにアミロイドβを標的とした治療開発が展開されてきた。一方、PSPにおいてはアミロイドβの関与は否定的であり、PSPのタウの凝集を支配する分子は長らく不明だった。
サルコシル不溶性フィラミンA、特にPSP患者の脳に豊富
タウオパチーで検出される凝集したタウは界面活性剤のサルコシルに溶けにくいことが知られている。今回、研究グループは、PSPの患者の脳組織をサルコシル含有の溶液に溶かし、タウ以外の不溶性の分子を液体クロマトグラフィータンデム質量分析(LC-MS/MS)によって探索。その結果、細胞骨格を担うアクチンと結合する作用が知られているフィラミンAを同定した。
PSPに加えて、健常者やPSP以外の神経難病(アルツハイマー病、大脳基底核変性症、ピック病、パーキンソン病、レビー小体型認知症)の患者の脳組織も用いて検討し、サルコシル不溶性のフィラミンAは、特にPSP患者の脳に豊富だということがわかった。
フィラミンAのゲノムコピー数変異やレアバリアント、患者の一部に見出す
続いて、病理学的な検討を行ったところ、PSP患者の脳ではフィラミンAが凝集したタウと共存していることを観察。それらが分子レベルでの関係性を持つことが予想された。
また、研究グループが解析した患者には、同時期にPSPを発症した一卵性双生児例が含まれており、彼らのゲノムを解析したところ、フィラミンAの遺伝子が2倍に重複したコピー数変異を認めた。
さらに、日本のPSP患者312人に対してフィラミンA遺伝子の塩基配列を解析。12人にp.Ser2523Asn型等のレアバリアントを認めた。このフィラミンA遺伝子レアバリアントについて、健常者499人の遺伝情報を用いた症例対照研究を実施し、オッズ比3.91の効果を持ってPSPの発症に寄与する可能性を示した。
細胞実験で、フィラミンAがタウの凝集を促進
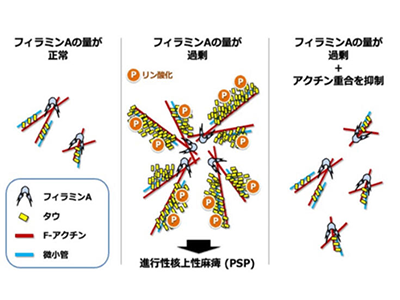
フィラミンAは生前の脳の発生過程において神経細胞を移動させるための重要な分子であることは既に知られていたが、タウへの影響については十分な知見が得られていなかった。そこで、培養細胞を用いた実験を行い、フィラミンAの過剰発現により、タウが過剰なリン酸化やタンパク質安定化を伴って凝集することを示した。また、共免疫沈降により、フィラミンAとタウが相互作用をもち、フィラミンAの過剰発現時にはタウにユビキチン化が増強し、分子シャペロンを誘導することを示した。
また、ラットのアストロサイトを単離してフィラミンAを過剰発現させると、細胞体内にリン酸化したタウが凝集した。こうしたフィラミンAによるタウの変化は、PSPの患者の脳内のタウの特徴と類似している。
フィラミンA過剰発現マウス作製、進行性核上性麻痺の患者と同様の脳内タウ凝集を再現
次に、in utero electroporationを用いてマウス胎仔脳に正常型フィラミンAを導入したところ、神経細胞において、移動障害とともに、タウの増加を認めた。アクチン結合作用を減弱させるp. Ala39Gly変異型フィラミンAを共発現させた場合には、移動障害やタウの増加は抑制された。
また、正常型フィラミンAを導入したマウス胎仔脳から単離した神経細胞には、アクチンの重合とタウの過剰リン酸化が生じていたが、アクチン重合阻害剤サイトカラシンDの投与により、タウの過剰リン酸化が解消された。これらより、フィラミンAはアクチンを介してタウに影響を与えることが考えられた。
さらに生後のマウス個体でも検証するため、アクチンとの相互作用に重要なドメインを集約した短縮型フィラミンAの発現を誘導するアデノ随伴ウイルス(AAV-ΔFLNA)を開発した。2か月齢の野生型マウスの脳内にAAV-ΔFLNAを遺伝子導入し1か月後に調べたところ、野生型マウス脳内でタウが増加。タウはマウスとヒトでは構造が異なる部分があるため、マウスのタウを持たずヒトのタウのみを発現する遺伝子改変マウス(ヒト化タウマウス)を用いて、同様に検討。その結果、ヒト化タウマウスにおいてもAAV-ΔFLNAを遺伝子導入によりタウの増加を確認した。
最後に、ヒトの全長フィラミンAを発現する遺伝子改変(FLNA-Tg)マウスを新たに作製した。FLNA-Tgマウスの脳内にはフィラミンAが過剰に産生される。すると、5か月齢の段階でサルコシル不溶性のリン酸化タウが検出された。病理学的な検討を行い、神経細胞とグリア細胞において、PSPの脳組織同様、フィラミンAが凝集したタウと共存していることが確認された。FLNA-Tgマウスから単離した神経細胞は、タウがリン酸化し神経突起の短縮など細胞形態が損なわれていたが、レンチウイルスを用いてフィラミンAの発現を是正すると、タウのリン酸化は軽減し、神経細胞の形態は正常化した。
PSP治療標的としてフィラミンAが有用である可能性
以上から、フィラミンAの過剰発現によるタウタンパク質量の増加は長らく不明であったPSPの分子病態の主要なファクターであると考えられる。フィラミンAをウイルス遺伝子導入や遺伝子改変したマウスがPSPの病態を十分に反映し、そしてPSPの治療標的としてフィラミンAが有用である可能性を示唆したとしている。
研究グループは、フィラミンAを治療標的とするPSP治療薬を開発するため、名古屋大学創薬科学研究科との共同研究や国内製薬企業との産学連携を行い、創薬スクリーニングのアッセイ系構築に着手している。また、FLNA-Tgマウスの更なる遺伝子改変やPSP患者由来のiPS細胞樹立も試みており、PSPの更なる病態解明とともに創薬研究を加速させていきたいと考えている、と述べている。
▼関連リンク
・名古屋大学 プレスリリース




