多施設共同研究で潰瘍性大腸炎への有効性が示されている青黛、作用機序は不明だった
慶應義塾大学は5月18日、潰瘍性大腸炎患者における炎症抑制に有効とされる生薬「青黛(せいたい)」が、炎症抑制性免疫細胞(制御性T細胞、Treg)を大腸上皮直下に誘導することを実証したと発表した。この研究は、同大医学部内科学教室(消化器)の金井隆典教授、同内視鏡センターの筋野智久専任講師、同医学部の吉松裕介特任助教らの研究グループが、愛媛大学大学院医学系研究科医学専攻分子病態医学講座の今村健志教授らとの共同研究として行ったもの。研究成果は、「Cell Reports」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
大腸は水分やミネラルの吸収を行う臓器であるとともに、腸内細菌叢や食物抗原などに対する感染防御の第一線を担っている。一方で、過剰な免疫反応は、炎症性腸疾患や食物アレルギーなどの自己免疫様疾患を引き起こす。そのため、正常な大腸には過剰な免疫反応を制御する細胞集団が存在しており、その中心的な役割を担う細胞としてTregが知られている。このTregが欠損あるいは機能不全に至ると炎症性腸疾患などの発症につながる。
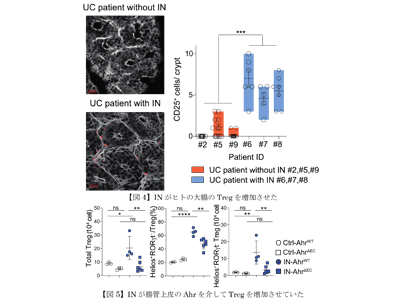
炎症性腸疾患の一つである潰瘍性大腸炎(ulcerative colitis、UC)は、持続性・反復性の下痢・粘血便・腹痛を主症状とし再燃寛解を繰り返す原因不明の難病。近年、生産年齢人口である若年層を中心に顕著に増加傾向にある。UCの病態の一つとして、免疫反応の活性化が知られていることから、免疫を抑制することを主眼に置いた治療が中心となっている。しかし、いずれの治療も無効な症例や、副作用の問題で使用できない症例も少なくない。そこで、研究グループが着目したのが、中国で古くからさまざまな慢性炎症性疾患に民間療法として使用されてきた生薬である「青黛(indigo naturalis、IN)」。研究グループはこれまでに、多施設二重盲検ランダム化比較試験においてINがUC患者に有効であることを示されていたが、これまで炎症が抑制される機序は不明だった。
芳香族炭化水素受容体(Aryl hydrocarbon receptor、Ahr)シグナルは免疫系の恒常性維持に重要であるとされている。このAhrに結合する物質(Ahrリガンド)は、ブロッコリーをはじめとした緑黄色野菜に含まれる成分で知られている。INはその成分に染料として知られるインジゴをはじめとするAhrリガンドを多く含むことから、これまでの免疫抑制治療とは異なる機序で炎症部位に作用することが想定された。
青黛<大腸上皮Ahrシグナル<特徴的なTregを上皮直下に誘導<炎症抑制
今回の研究では、まず、マウスにおいて、INが腸管の炎症を抑制することを実証した。次に、INは大腸に特徴的な遺伝子であるIkzf2(Helios)とGzmaを発現するTreg(INTreg)を増加させていることを示した。さらに興味深いことに、IN-Tregは大腸上皮に近い管腔側(管の内側)に局在していた。このことはIN-Tregが何らかの作用で腸管上皮に働きかけている可能性を示唆している。
実際に、潰瘍性大腸炎の症状が治まった状態(寛解期)の患者に内視鏡検査を施行し、直腸粘膜の浅い層から組織を採取した。すると、IN服用患者ではIN非服用患者と比較してTregが増加していることが示された。このように、マウスおよびヒトにおいて、腸管上皮の直下にある炎症抑制細胞をINが誘導することがわかった。
さらにこの作用は、INが腸管上皮細胞を通じて引き起こしていることを見出した。実際に腸管上皮特異的にAhrシグナルが入らないマウス(AhrΔEC)を使用すると効果がキャンセルされた。
以上から、これまで作用機序が不明であったINが、マウスおよびヒトにおいて、大腸の上皮Ahrシグナルを介して特徴的な遺伝子を発現するTregを上皮直下に誘導することにより炎症を抑制するというメカニズムが示された。
作用成分はまだ不明だが同定できれば新治療につながる
今回の研究は、炎症性腸疾患における生薬「青黛」の有効性についてのメカニズムの詳細を解析したもの。これまでに潰瘍性大腸炎治療において、Tregを移入することで大腸の炎症抑制を図る系は国内外において多くチャレンジされてきたが、特定の組織に集中させることができず実用化されていない。一方で、青黛の中のどの成分がこのような作用を起こしているかはいまだ不明瞭で、青黛は長期服用により重篤な副作用が報告されている。
「今後、青黛によるTregを介した上皮組織修復促進メカニズムを解明し、同メカニズム内の因子について解析することができれば青黛治療におけるバイオマーカーを見出せる可能性もあり、また、作用成分を同定することができれば、自己の体内でTregを炎症部位に誘導し炎症を沈める治療が可能となる」と、研究グループは述べている。
▼関連リンク
・慶應義塾大学 プレスリリース



