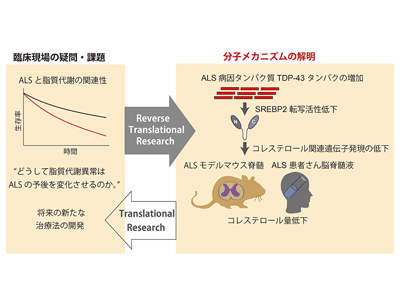
ALSと脂質代謝の関連性についてリバーストランスレーショナルリサーチ
京都大学iPS細胞研究所(CiRA)は5月16日、筋萎縮性側索硬化症(ALS)病因タンパク質であるTAR DNA-binding protein of 43 kDa(TDP-43)を過剰発現する細胞培養系を用いて、TDP-43が脂質代謝のコレステロール生成を制御する転写因子Sterol regulatory element-binding protein 2(SREBP2)の転写活性を抑制してその下流遺伝子群の発現を抑制していることを明らかにし、さらに、生体レベルでもALSを生じるTDP-43遺伝子改変マウス脊髄組織でSREBP2の活性が低下し、同組織とALS患者の髄液中において、実際にコレステロール量が減少していることを見出したと発表した。この研究は、CiRA増殖分化機構研究部門の江川斉宏 元特定研究員(現 京都大学医学部附属病院脳神経内科院内講師、理化学研究所(理研)バイオリソース研究センター(BRC)iPS創薬基盤開発チーム客員研究員)、CiRA同部門の井上治久教授(理研BRC同チームチームリーダー)、徳島大学大学院医歯薬学研究部の和泉唯信教授らの研究グループによるもの。研究成果は、「Scientific Reports」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
研究グループは先行研究で、家族性のALSを生じるTDP-43変異を有する患者のiPS細胞を用いて、患者の運動神経細胞では、脂質代謝関連の遺伝子発現が低下していることを見出していた。さらに、近年、脂質代謝異常や発症前の体脂肪がALSの予後に影響を及ぼし、高コレステロール血症が、ALSの予後に保護的に働くこと、高カロリー・高脂質食による栄養療法は進行速度が速いALSの生命予後を改善することが報告されている。しかし、その分子メカニズムはわかっていなかった。そこで今回、研究グループは、この臨床的な疑問に対して、ALSの主要病因タンパク質であるTDP-43に着目したリバーストランスレーショナルリサーチを進めた。
TDP-43がSREBP2の転写活性を低下させコレステロール合成を抑制
まず、TDP-43を過剰発現する細胞株を用いて、遺伝子発現解析を行った結果、コレステロール生成を制御する転写因子SREBP2とその下流遺伝子群の発現が抑制されていることを見出した。
SREBP2タンパク質(T-SREBP2)は、N末端側の一部(N-SREBP2)が切り出されて、コレステロール関連遺伝子の転写活性部位であるsterol-regulatory elements(SREs)に結合してその発現を調節することが知られている。TDP-43を過剰発現させたところ(Dox+)、N-SREBP2の発現量が低下することがわかった。SREBP2の転写因子としての活性を測定すると、TDP-43タンパク質の量が増えるとともに、SREBP2の転写活性が低下し、細胞内コレステロール量が低下した。これらから、TDP-43がSREBP2の転写活性を低下させ、コレステロール合成を抑制していることがわかった。
ALSモデルマウスやALS患者髄液で実際にコレステロール量の減少を確認
最後に、生体レベルでTDP-43がコレステロール合成を低下させているかを検証するために、ALSを呈するメスのTDP-43遺伝子改変マウスの脊髄とALS患者の髄液におけるコレステロールを測定した。結果として、ALSの症状を再現するメスのTDP-43遺伝子改変マウス脊髄のN-SREBP2の量は有意に低下し、ALSの運動症状の発症前、発症後のいずれのステージにおいても脊髄中コレステロール量が低下していた。さらに、ALS患者の髄液中においても、コレステロール量が低下していることを見出した。
今回の研究により、ALS病因タンパク質TDP-43が、コレステロール合成を制御する転写因子であるSREBP2の転写活性を通して、コレステロール合成を制御することが明らかになった。研究グループは、「ALSにおける脂質代謝異常と栄養療法の有効性の分子メカニズムの一端を明らかにしたと考えられ、今後ALS治療に向けた新たな治療ターゲットになると期待される」と、述べている。
▼関連リンク
・京都大学iPS細胞研究所 ニュース



