血球系細胞に注目し、卵黄嚢と大動脈-生殖腺-中腎に焦点をあてて解析
神戸大学は5月2日、特発性自閉症の原因が、胎児の時の造血系細胞のエピジェネティックな異常であり、その結果が脳や腸に見られる免疫異常であることを明らかにしたと発表した。この研究は、同大大学院医学研究科生理学分野の内匠透教授(理化学研究所生命機能科学研究センター客員主管研究員)、Chia-Wen Lin研究員らの国際共同研究グループによるもの。研究成果は、「Molecular Psychiatry」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
自閉症(自閉スペクトラム症)は、患者数が急増しているにもかかわらず、未解明な部分の多い発達神経症。免疫異常は現在においては、さまざまな疾患の原因と考えられるが、自閉症の発症においても重要な役割を果たしている。脳内炎症や末梢免疫系の障害は、自閉症患者において頻繁に観察される。さらに、免疫異常は腸内細菌叢の異常を併発し、これも脳腸軸を介して発症に関与していると考えられている。しかし、これらの免疫異常の背後にある本質的なメカニズムは、まだ解明されていない。
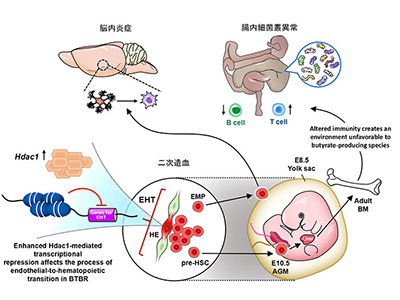
研究グループは、自閉症発症における免疫障害の重要な発達段階と免疫系の広範な関与を考慮し、共通の病因が広範な免疫調節不全の根底にあり、異なるタイプの前駆細胞にあると仮定。免疫細胞のもとになる血球系細胞に注目し、さらに胎児の時の造血に関わる卵黄嚢(YS)と大動脈-生殖腺-中腎(AGM)に焦点をあてて解析を行った。これらの結果は、脳内炎症と末梢免疫系の異常の共通の祖先を探すことになる。
AGM血球系細胞の一細胞RNA-seq解析により、免疫異常の病因として「HDAC1」を同定
研究では、原因のわからない自閉症のモデルとして、自然発症のBTBRマウスを用いた。BTBRマウスの一細胞RNAシーケンス(sc-RNA seq)により、免疫異常の起源をYSとAGMの胚の段階まで遡り、マクロファージ(ミクログリア)と末梢免疫細胞が分化している場所を特定した。YSとAGMにおける二次造血の一細胞レベルの解析により、発生初期段階における希少な前駆細胞内の分子レベルでの病理学的メカニズムを特定することに成功。つまり、これらの病態の根底にヒストン脱アセチル化酵素であるHDAC1を介した転写制御の共通メカニズムを見出した。
また、特定の発生段階においてエピジェネティックな機構を操作することで、脳や末梢組織における免疫異常を回復させることができることを示した。すなわち、共通のメカニズムとして同定したヒストン脱アセチル化酵素HDAC1の阻害剤(酪酸ナトリウム、ロミデプシン)をBTBRマウスの胎児期に投与すると、炎症性サイトカインの上昇やミクログリアの活性化が抑制された。
免疫細胞と腸内細菌のバイオマーカーが、免疫異常を有する自閉症のサブタイプの分類手段となる可能性
さらに、免疫異常が自閉症モデルマウスの特定のプロファイルの腸内細菌の異常を決定するという因果関係を明らかにし、免疫細胞(Treg)と腸内細菌のバイオマーカーが免疫異常を有する自閉症のサブタイプを分類する手段となる可能性があることを明らかにした。
以上のことから、自閉症に見られる脳と腸などの末梢臓器での異常は、免疫細胞の祖先である造血幹細胞系のエピジェネティックな異常によって引き起こされることが明らかになった。
自閉症のサブタイプ分類が自閉症治療の新たな道を切り開く第一歩に
今回の研究成果により、自閉症における全身性免疫異常という長年の謎が明らかにされただけでなく、環境リスク要因の異なる自閉症モデルに共通する病因として、エピジェネティックな障害が果たす役割が示唆された。
「将来的に自閉症の精密医療、個別化医療を発展させるためには、発症メカニズムに応じた自閉症のサブタイプ分類が必要であり、自閉症治療の新たな道を切り開く重要な第一歩となる」と、研究グループは述べている。
▼関連リンク
・神戸大学 研究ニュース




