免疫異常が複数の神経変性疾患に共通して関与するかを解析
国立精神・神経医療研究センター(NCNP)は4月26日、神経変性疾患に共通した病態伝播・拡散のしくみとして、免疫細胞が引き起こす新しい神経細胞障害メカニズムを明らかにしたと発表した。この研究は、NCNP神経研究所免疫研究部の大木伸司室長、山村隆特任研究部長、東京工業大学生命理工学院の林宣宏教授、同大学院生の高橋文緒氏らの研究グループによるもの。研究成果は、「iScience」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
神経変性疾患は、筋萎縮性側索硬化症(ALS)、アルツハイマー型認知症(AD)などを含む、中枢神経系の難病。例えばALSでは、脳脊髄に分布する運動ニューロンが選択的に障害されることで、運動機能の異常を呈し、ADでは、記憶を司る海馬周囲の神経細胞の障害により、認知機能が損なわれる。臨床症状や経過は疾患ごとにさまざまだが、ALSではTDP-43、SOD1、FUSなどのタンパク質が、ADではアミロイドβ(Aβ)やTauなどのタンパク質が、それぞれ神経細胞内外で凝集体を形成して神経細胞死を引き起こすことが、主要な原因と考えられている。ところが最近、細胞外タンパク質凝集体であるAβの除去が、必ずしもAD患者の症状改善につながらないことや、凝集タンパク質が形成される位置と病変部位が必ずしも相関しないことなどがわかってきた。さらに遺伝などの影響なしに発症する患者では、検査などを通じて凝集タンパク質の種類を特定することも困難はあり、治療戦略を考える上で大きな障壁となっていた。
最近では、脳内の神経細胞以外の細胞(グリア細胞など)の異常な挙動が、各神経変性疾患に共通して神経細胞死に関わるという考え方が広がっている。神経変性疾患ごとに独立した原因を探ることで治療法に結びつけることを目指す研究だけでなく、種々の神経変性疾患に共通したイベントから、これまで見過ごされてきた原因を明らかにするような研究にも目が向けられるようになってきた。そのような状況下で研究グループは、以前に発見した免疫細胞の機能異常が引き起こす神経細胞死のメカニズムが、複数の神経変性疾患でも共通に認められる神経細胞障害のメカニズムであるかどうかを検証するための研究を進めてきた。
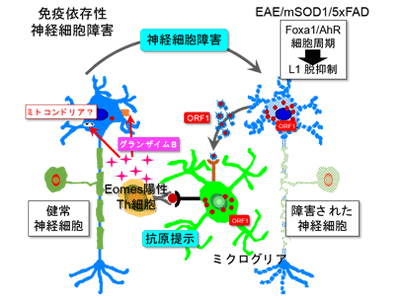
各病態モデルマウスに共通してエオメス陽性ヘルパーT細胞が増加、ORF1が引き金
多発性硬化症(MS)は、神経軸索を取り巻く髄鞘の障害によって生じる脱髄疾患だが、MSの亜型である二次進行型MS(SPMS)では、神経変性疾患と似た神経細胞障害の病理像や経過を示すことが知られている。研究グループは、以前にSPMSのモデルマウスを確立し、同モデルの解析を通じてSPMSの中心的な病態である神経細胞障害に、エオメス陽性ヘルパーT細胞という免疫細胞が重要な役割を果たすことを報告した。エオメス陽性ヘルパーT細胞は、グランザイムBというタンパク分解酵素を分泌して、神経細胞死を引き起こす。研究グループは、SPMS患者の血中エオメス陽性ヘルパーT細胞頻度が、障害進行度とよく相関すること、SPMS患者の脳内に同細胞が広く分布し、大部分がグランザイムBを発現することを示し、神経細胞死を引き起こすSPMSの病原性細胞であることを明らかにした。エオメス陽性ヘルパーT細胞は、炎症環境が引き金となって生成することから、研究グループは、慢性炎症を伴う神経変性疾患にも、同細胞が関わるのではないかと考えた。
そこで、ALSとADの病態モデルマウスであるmSOD1マウスと5xFADマウスを用いて免疫細胞の脳内集積を調べたところ、発症に伴ってエオメス陽性ヘルパーT細胞が増えていることがわかり、病態との関連が示された。エオメス陽性ヘルパーT細胞がグランザイムBを放出するには、抗原を介した活性化が必要と考えられるため、研究グループは、エオメス陽性ヘルパーT細胞を活性化する抗原の探索を実施。その結果、ゲノムの半分近くにも及ぶトランスポゾンといわれる塩基配列の中で、レトロウイルス様の生活環を持つレトロトランスポゾンの1つであるLINE-1(長鎖散在反復配列-1、Long interspersed nuclear element-1、L1)がコードするORF1というタンパク質が、エオメス陽性ヘルパーT細胞を活性化することを発見した。
ORF1<エオメス陽性ヘルパーT細胞活性化<グランザイムB放出<神経細胞死
L1は、進化の過程で自身の遺伝子断片をコピー&ペーストの要領で複製する「レトロ転位」を繰り返し、総延長がヒトゲノム全体の20%弱にもおよぶ領域を占め、その中には50万コピーにも及ぶL1遺伝子断片を含む。神経細胞におけるL1の活性化は、神経変性疾患に共通する特徴的な反応として良く知られていたが、その意義はよくわかっていなかった。神経細胞のL1活性化により発現したORF1タンパク質が、エオメス陽性ヘルパーT細胞を活性化するのであれば、結果的にグランザイムBが放出されて、神経細胞が死ぬ可能性が考えられる。
そこでSPMSモデルマウス、mSOD1マウスと5xFADマウスの3種類のモデルマウスの神経細胞で検討したところ、いずれのモデルマウスでも、神経細胞のL1活性化によりORF1タンパク質の量が増えていることがわかった。興味深いことに、L1活性化のメカニズムはマウスごとに異なっており、SPMSモデルマウスではエピジェネティックな変化と、芳香属炭化水素受容体(Aryl hydrocarbon receptor, AhR)の活性化が関わっていた。一方、mSOD1マウスでは、神経細胞の細胞周期が部分的に進むことで、L1活性化が生じることがわかった。
最後に研究グループは、ORF1タンパク質によって活性化したエオメス陽性ヘルパーT細胞が、グランザイムBの放出を介して神経細胞死を引き起こすかどうかを調べた。まずマウスの中枢神経系からTh細胞を分離し、ORF1で刺激すると、グランザイムBの放出が明らかに増えた。さらに分離したTh細胞を、初代培養神経細胞と共にin vitroで培養すると、神経細胞の生存率が明らかに低下した。
以上の結果から、3種のモデルマウスの中枢神経系において、神経細胞由来のORF1タンパク質がエオメス陽性ヘルパーT細胞の活性化を促し、放出されたグランザイムBが神経細胞死を引き起こすことが示された。ORF1は元々神経細胞の内部に分布するタンパク質であり、最初に何らかの理由で神経細胞が細胞死を起こすと、細胞外に放出されたORF1がエオメス陽性ヘルパーT細胞を活性化し、周囲に拡散したグランザイムBが、さらに近くの神経細胞にダメージを与える、という反応が繰り返されることで、神経細胞障害が伝播、拡大していくことが明らかとなった。
神経変性疾患の画期的な治療法開発に期待
今回の研究により、免疫依存性神経細胞障害によって神経細胞死が繰り返されることにより、最初は微小な領域にとどまっていた病変部位が進行性に拡大することで、臨床症状が顕在化して神経変性疾患が発症する可能性が示された。これまで神経変性疾患研究においては、凝集タンパク質の蓄積によって生じる神経細胞死の解析が主流だったが、今回の研究により、免疫細胞が引き起こす神経細胞障害機序がここに加わることによって、わずかに生じた初期の(凝集タンパク質依存的な)神経細胞死が引き金となって、ORF1抗原の放出とこれを介した免疫細胞が引き起こす神経細胞障害が発動することがわかった。そしてORF1抗原の放出と免疫細胞が引き起こす神経細胞死が繰り返されることにより、神経細胞死を起こした領域が、周辺へと伝播、拡大していく分子機序が明らかとなった。
「今後は、免疫細胞が引き起こす神経細胞障害を制御する方法の探索、L1の活性化が(凝集タンパク質依存的な)神経細胞死にも関与する可能性を調べることにより、神経変性の伝播、拡大を抑えて、病変部位の拡大による臨床症状の顕在化を回避するための、新しい治療戦略の開発が期待される」と、研究グループは述べている。
▼関連リンク
・国立精神・神経医療研究センター トピックス




