ラット脳から分離培養した脳細胞や高アンモニア血症モデルマウスを作成、アルツハイマー病発症との関連性を探索
新潟大学は4月18日、血液中のアンモニア濃度が上昇すると、脳内の非神経細胞であるグリア細胞の一つ、アストロサイトでのアミロイド前駆タンパク質(APP)量が上昇し、アルツハイマー病の特徴である老人斑の主要な構成成分とされるアミロイドβ42が増加することを発見した。この研究は、同大大学院医歯学総合研究科口腔生化学分野の照沼美穂教授らの研究グループによるもの。研究成果は、「Journal of Biological Chemistry」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
有毒な物質であるアンモニアは、体を構成するタンパク質の代謝の過程で産生される。また、腸内細菌が食物中のタンパク質を分解することでも産生される。腸内で産生されたアンモニアは体内に吸収されるため、体内で産生されたアンモニアも含めると、かなりの量のアンモニアが体の中に蓄積されることになる。しかし、ヒトの体にはアンモニアを利用する機構や、無毒な尿素に変換して尿として排出する機構が備わっている。一方、タンパク質の過剰摂取や便秘、薬の副作用やアンモニアの排出機構の異常などがあると、血液中のアンモニア値が上昇する高アンモニア血症を発症する。これは子どもから大人まで年齢に限らず発症する可能性がある。
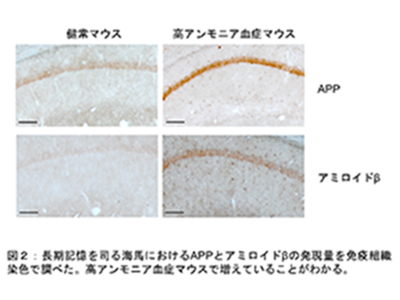
高アンモニア血症は認知機能障害や意識障害などの中枢神経症状を起こすことが知られており、ひどい場合には死に至る。これまでに、アルツハイマー病患者の血液で高いアンモニア値が報告されるなど、アンモニアとアルツハイマー病の関連性が報告されていたが、アンモニアがどのようにしてアルツハイマー病の病態生理に関与しているかは明らかではなかった。そこで研究グループは、ラットの脳から分離培養した脳細胞や高アンモニア血症モデルマウスを作成し、アルツハイマー病発症との関連性を探索し、そのメカニズムの解明を目指した。
アミロイドβ42が細胞膜上の成熟APPから産生されたものであると判明
脳では、アストロサイトがアンモニアを利用することが知られている。そこで研究グループは、ラットの脳からアストロサイトを分離培養し、アンモニア刺激を行った。その結果、APPの発現上昇が観察された。アンモニアは一般に細胞内のpHを上昇させることでタンパク質分解を阻害することが知られている。そのため、培養液中のpHを上昇させて細胞内のAPPの発現量を検討したが変化はなく、アンモニアの成分自体がAPPの発現量を上昇させることがわかった。また、発現が上昇しているAPPは、細胞内で成熟した成熟APPであり、修飾が未熟で機能を持っていない未成熟APPの発現量には変化がないこともわかった。
APPは細胞膜に発現して機能する膜タンパク質。アンモニア刺激後のAPPの局在を観察すると、細胞内に移動していることがわかった。通常、細胞内に入り込んだ膜タンパク質は、リソソームに運搬されて分解される。しかし、APPはリソソームではなく、主に小胞体に運搬されていることがわかった。そこで研究グループは、アンモニア刺激後のアストロサイトの小胞体でアミロイドβが産生されるかを検討した。その結果、凝集性の高いアミロイドβ42のみ、産生が著しく上昇していることがわかった。
アミロイドβ42の産生はほとんど小胞体でのみ観察され、またAPPの細胞膜から細胞内への移動を阻害すると小胞体内でのアミロイドβ42は観察されないことから、このアミロイドβ42は細胞膜上の成熟APPから産生されたものであることがわかった。
高アンモニア血症の発症でアンモニアによるアミロイドβ産生が亢進、アルツハイマー病を発症する可能性
培養アストロサイトで得られた研究結果をモデル動物で検討するために、高アンモニア血症マウスを作成して脳内のAPPとアミロイドβを観察したところ、アストロサイトの炎症反応や神経変性が観察され、アストロサイト内でのAPPとアミロイドβの発現上昇が認められた。このことから、高アンモニア血症を発症すると、アンモニアによるアミロイドβ産生が亢進し、アルツハイマー病の発症につながる可能性があることがわかった。
これまでにもアルツハイマー患者の脳で、アストロサイト内にアミロイドβは観察されていた。しかし、それらは神経細胞が産生したアミロイドβをアストロサイトが貪食したものであると考えられてきた。同研究により、全く新しい、アストロサイトによるアミロイドβの産生メカニズムも明らかになった。
アストロサイトによるアミロイドβ産生、新規標的となる可能性
今回の研究により、高アンモニア血症がアストロサイトでのアミロイドβ産生を促進させることが明らかになった。
「これまで神経細胞による産生が注目されてきたアミロイドβだが、アストロサイトでも産生されること、さらにはその過程が小胞体へのAPPの運搬によることが明らかになり、アルツハイマー病治療の新規標的になることが期待される」と、研究グループは述べている。
▼関連リンク
・新潟大学 ニュース




