日本では「福山型筋ジストロフィー」が最も多い、糖鎖異常型筋ジストロフィー
愛媛大学は4月14日、糖鎖異常型の筋ジストロフィーモデルマウスの治療に成功したと発表した。この研究は、同大大学院医学系研究科の金川基教授、東京大学大学院医学系研究科の戸田達史教授、神戸大学大学院医学研究科の徳岡秀紀医師らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
糖鎖は、タンパク質や脂質に結合した形で機能を発揮する生体にとって重要な物質。その重要さゆえに、糖鎖の生合成異常は疾患の原因にもなる。糖鎖の異常を原因とする疾患は、優に百種を越える。一方で、糖鎖の生合成系路や構造の複雑さから、ゲノムやタンパク質領域に比べ相対的に研究が遅れている感は否めないが、糖鎖がもつ生物学的意義を読み解くことで、未知の生命現象や疾患を解明できると期待が高まっている研究分野だ。
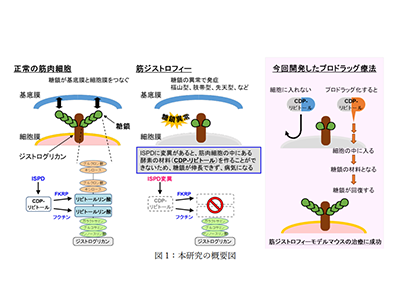
筋ジストロフィーは、進行性に筋力の低下を認める遺伝性疾患の総称で、その病型は多岐にわたる。2000年代に糖鎖の異常を認める筋ジストロフィー症例が相次いで発見され、どの症例においても共通してジストログリカンというタンパク質に糖鎖異常が見られた。このことから、糖鎖異常型(ジストログリカン異常症)という新しい疾患概念が確立された。糖鎖の異常によって、ジストログリカンが担う細胞外基底膜と細胞膜の連携が破綻し、筋肉細胞が壊れやすくなると考えられている。
糖鎖異常型筋ジストロフィーは、先天性の筋病変に加えて脳障害なども伴う最重篤型の筋ジストロフィー。日本では、福山型筋ジストロフィーが最も多くみられる糖鎖異常型筋ジストロフィーで、小児期筋ジストロフィーの中では二番目に多い疾患だ。福山型筋ジストロフィーの発見、その原因遺伝子フクチンの発見、そして糖鎖と疾患との関係を明確にした同研究グループの研究成果は国内外で広く認められている。
先行研究より、筋ジストロフィー発症の原因になる糖鎖構造・生合成に関わる酵素を明らかに
研究グループは先行研究により、筋ジストロフィー発症の原因になる糖鎖の構造や、その生合成に関わる酵素を明らかにしてきた。中でも、リビトールリン酸という哺乳動物ではそれまで存在が知られていなかった化合物が糖鎖の中に存在していること、その生合成に関わる酵素(フクチン、フクチン関連タンパク質FKRP)、およびリビトールリン酸の材料となる物質であるCDP-リビトールとその合成酵素ISPD(イソプレノイドドメイン含有タンパク質)の発見は、国際的な教科書を書き換えるインパクトを残したという。
一連の研究から、糖鎖異常型筋ジストロフィーの理解は進んだが、有効な治療法は未だに存在せず、国内外から画期的な治療法の開発が切望されている。そこで、今回の研究では、糖鎖異常型筋ジストロフィーの発症メカニズムの解明と治療法の開発を目指した。
SPD欠損マウスを作出、ISPD遺伝子治療でCDP-リビトール量と糖鎖が回復、筋ジストロフィーの進行を抑制
まず、糖鎖の生合成に必要な物質のひとつCDP-リビトールの合成酵素ISPD(イソプレノイドドメイン含有タンパク質)の異常によって発症する筋ジストロフィーのモデルとして、ISPD欠損マウスを作出。ISPD欠損マウスは、筋力と筋重量の低下を示し、病理学的に進行性の筋ジストロフィー様の所見を呈し、患者でみられる病変を再現していた。また、本来ISPD酵素が合成すべきCDP-リビトールの量が激減。その結果、糖鎖異常も生じており、これらの異常が発症要因であることが明らかになった。
この疾患モデルマウスに対し、アデノ随伴ウイルスベクターを用いてISPD遺伝子を導入した結果、CDP-リビトール量と糖鎖が回復し、筋ジストロフィーの進行を抑制できることが判明。このことから、ISPD変異型筋ジストロフィーは治療可能であることが示され、同時に、CDP-リビトールを補充することで治療につながることも示唆された。
CDP-リビトールプロドラッグ療法、ISPD欠損マウスへの長期投与で治療効果を発揮
しかし、CDP-リビトールは細胞内への送達効率が極めて低いため、そのままの形状では薬剤として利用できない。そこで、CDP-リビトールを化学的に修飾することで細胞内への送達性を高め、かつ細胞内では代謝反応によって生理活性型のCDP-リビトールへと変換できるような仕組みを施した(プロドラッグ化)。
CDP-リビトールのプロドラッグ候補化合物を十種合成し、それぞれの送達活性や生体内での毒性を検証した結果、CDP-リビトール分子上の4か所にアセチル基を導入した化合物が最も効果が高いプロドラッグであることが判明。そして、このプロドラッグ化合物を長期的にISPD欠損マウスに投与したところ、治療効果を発揮することが明らかになった。
以上の結果から、ISPD変異型筋ジストロフィーに対して、遺伝子治療とCDP-リビトールプロドラッグ療法という新しい治療法の提唱に至った。
CDP-リビトールのプロドラッグ化合物、更なる改良後、臨床治験へ期待
今回の研究成果は、遺伝子治療法やプロドラッグ療法など、筋ジストロフィー治療薬開発に向けた臨床応用につながると期待される。遺伝子治療は疾患の原因となる遺伝子の種によって適応の可否が決まる治療法だが、プロドラッグ療法は原因遺伝子が異なる疾患にも適応できる可能性がある。例えば、CDP-リビトールを基質として用いる酵素(フクチンやフクチン関連タンパク質FKRP)に変異がある場合でも、プロドラッグの投与により筋細胞内のCDP-リビトール濃度が増加すれば、変異酵素の活性が増大し、糖鎖回復ひいては治療につながると考えられている。福山型筋ジストロフィー(フクチン変異)の患者は国内では1,000~2,000人程度、フクチン関連タンパク質FKRPの変異患者は世界で数千~1万人程度存在すると推察されており、プロドラッグ療法の適応拡充が見込まれるという。
ISPD遺伝子に変異がある筋ジストロフィー患者も、国内外で報告されている。今後は、CDP-リビトールのプロドラッグ化合物の生体内安定性や細胞内への送達効率などに更なる改良を加えた後、臨床治験へと展開することが期待される。
また、CDP-リビトールのように糖鎖の材料となる化合物(糖ヌクレオチド)の生合成不全は、先天性糖鎖異常症の原因にもなる。今回開発したプロドラッグ化技術は、筋ジストロフィー以外の疾患にも応用が見込まれる。
筋ジストロフィーや先天性糖鎖異常症のような患者数の少ない希少難治性疾患は世界で7,000種類以上存在するといわれているが、患者数が少ないため治療法開発は遅れをとっている。しかし、全世界の希少疾患患者を総計すると4億人にものぼると推定され、希少という言葉で片付けられない現状だ。事実、世界的にも希少疾患治療薬の研究開発が熱を帯びており、承認される医薬品や売り上げシェアも右肩上がりに増加している。今回の研究対象となったISPD変異型をはじめとする糖鎖異常型筋ジストロフィーは、いずれも希少疾患。このような背景を鑑みても、今回の論文で発表した成果は、産学官の垣根を超えて社会的にも国際的にも意義のある研究と言える、と研究グループは述べている。
▼関連リンク
・愛媛大学 プレスリリース






