ポドプラニン分子、AYA世代が好発年齢の希少がん・骨肉腫で発現「高」
がん研究所は4月6日、ポドプラニン上の血小板凝集誘導に主要な役割を果たしているPLAG4ドメインに結合し、その血小板凝集誘導活性を阻害するヒト化中和抗体AP201を創成したと発表した。この研究は、がん研究会がん化学療法センターの藤田直也所長、がん化学療法センター基礎研究部の竹本愛主任研究助手、高木聡研究員、宇梶太雄研究員、片山量平部長ら、アピ株式会社医薬事業本部の刑部伸彦係長、柿野衛係長、高山和江課長代理(開発当時)、市原賢二部長らの研究グループによるもの。研究成果は、「Clinical Cancer Research」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
研究グループは、がん細胞によって誘導される血小板凝集誘導機構の研究を進めており、これまでに、がん細胞依存的な血小板凝集に関わる分子として世界で初めてポドプラニン分子(同定当時:Aggrus)を同定していた。その詳細な解析を行うことで、PLAG4ドメインと新規に同定して命名した部位に強い血小板凝集誘導活性があること、PLAG4ドメインに結合しポドプラニンによる血小板凝集を阻害するマウス抗ヒトポドプラニン中和抗体PG4D2を樹立することに成功していた。
ポドプラニン分子は、血小板上に発現しているCLEC-2分子と結合することで血小板凝集を誘導しているため、樹立したマウス中和抗体PG4D2は、ポドプラニンとCLEC-2分子との結合を立体的に阻害している中和抗体であることがわかっていた。ポドプラニン分子は、AYA世代(15~29歳)を好発年齢とする骨肉腫でも発現が高いことが明らかとなっている。骨肉腫は、約50~100万人に1人という割合で発生する希少がんだ。
ポドプラニン標的の新規がん治療用ヒト化抗体を創成、安全性の高さも示唆
今回研究グループは、マウス中和抗体PG4D2のヒト化に取り組み、ヒトIgG4サブクラスであるヒト化中和抗体AP201を創成することに成功した。
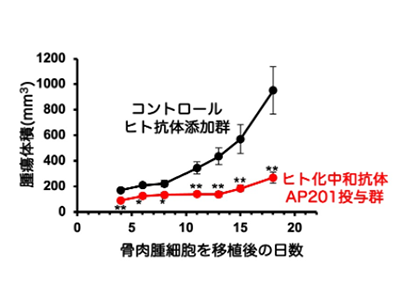
日本人ヒト骨肉腫検体より樹立された臨床検体由来細胞株や公的細胞バンクより入手した細胞株を実験動物に移植し、ヒト化中和抗体AP201投与による治療実験を実施。その結果、ヒト化中和抗体AP201の投与により、骨肉腫の増殖と転移が抑制することが確認され、本抗体の骨肉腫治療への応用が可能であることが示唆された。
ヒト化中和抗体AP201の認識部位をマウスポドプラニンの相同部位と置換したノックインマウス(PDPNKI/KIマウス)にヒト化中和抗体AP201を投与した場合も、免疫反応が正常と変わらないマウスであるにも関わらず、毒性を示すような兆候は認められなかった。ヒト化中和抗体AP201の安全性が高いことが示唆されたとしている。
脳腫瘍・食道がんなど、他のがん種でも治療効果のある可能性
今回の研究結果などにより、骨肉腫細胞上に発現しているポドプラニンが血小板を凝集させることを起点とすることで、骨肉腫の増大や転移が促進されていることが明らかとなった。ポドプラニンは、骨肉腫以外にも脳腫瘍・食道がん・肺扁平上皮がん・悪性中皮腫・精巣腫瘍・膀胱がんなど様々ながんでも発現亢進が認められている。したがって、同研究成果で示した骨肉腫に対する治療効果は、骨肉腫以外のがんでも認められる可能性が高いと考えられる。
また、ヒト化中和抗体AP201あるいは作製元のマウス中和抗体PG4D2を免疫系が正常と同じように維持されているノックインマウス(PDPNKI/KIマウス)に投与しても、毒性兆候が認められなかった事実は、ヒトに対しても安全に投与できる可能性を示しているという。その点でも、がん治療薬としての開発可能性は高いとしている。
臨床試験など開発継続の予定
研究グループは今後、臨床試験実施の製薬企業を探して連携することで、ヒト化中和抗体AP201をいち早く患者に届けられるように、臨床試験を含む開発を継続していく予定だ。
なお、ヒト化中和抗体AP201を共同開発していたアピ株式会社は、塩野義製薬との共同事業としてのCOVID-19に対するワクチン製造に注力することとなり、ヒト化中和抗体AP201の全ての権利(知財を含んだ今後の前臨床開発並びに臨床開発における権利)はがん研究会が承継している。
▼関連リンク
・がん研究所 ニュースリリース



