独自に開発したヘテロ核酸でEAEマウスを非侵襲的に治療できるか?
東京医科歯科大学は4月1日、従来のアンチセンス核酸とは異なる送達機構を有するヘテロ核酸を用い、非侵襲性投与ルート(全身投与)から多発性硬化症動物モデルであるEAEマウスの活性化ミクログリア・中枢神経浸潤マクロファージの内在性遺伝子発現の抑制と表現型の改善に成功したと発表した。この研究は、同大大学院医歯学総合研究科脳神経病態学分野(脳神経内科)の横田隆徳教授、永田哲也プロジェクト准教授、大谷木正貴大学院生(当時)、西李依子大学院生らの研究グループによるもの。研究成果は、「Molecular Therapy」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
多発性硬化症では、リンパ球だけでなく活性化したミクログリアも、リンパ球やマクロファージなどの免疫細胞の中枢神経系への動員を促し神経炎症に加担する。そして、ミクログリアと中枢神経浸潤マクロファージは、リンパ球への抗原提示、炎症性サイトカイン・フリーラジカルなどの産生を介し、髄鞘の破壊(脱髄)を引き起こす。ゲノム解析の進展により、ミクログリア・マクロファージの多発性硬化症における治療標的としての可能性が、徐々に明らかにされている。
核酸医薬は内在性遺伝子の発現を制御することが可能であり脊髄性筋萎縮症の治療薬として既に承認され、ハンチントン病、筋萎縮性側索硬化症、アルツハイマー病、パーキンソン病などの中枢神経疾患で臨床試験が進行中ではあるが、血液脳関門を有する中枢神経系への送達が困難である事から、髄腔内投与が必要だ。髄腔内投与は静脈内投与や皮下投与などの全身投与と比べ侵襲性が高いという問題があり、より安全に使用できる核酸医薬の開発が望まれる。そこで、より安全な投薬ルートで効率的遺伝子制御効果を可能とする治療薬の開発を目的に、今回研究グループは、独自に開発したヘテロ核酸を用い、多発性硬化症の動物モデルであるEAEマウスのミクログリア・中枢神経浸潤マクロファージの制御を試みた。
ヘテロ核酸は非侵襲性の全身投与でミクログリア・マクロファージの遺伝子発現を制御
DNA/RNAヘテロ2本鎖核酸は、東京医科歯大学脳神経内科の研究グループが独自に開発した、従来の核酸医薬と異なる分子構造と多様なデリバリー分子、さらに細胞内作用メカニズムを有する新しい医薬技術であり、中でもコレステロールリガンドを結合させたヘテロ核酸は、全身投与で健常マウスの血液脳関門を通過し脳へ送達されミクログリアにおいて遺伝子発現抑制効果を発揮する。
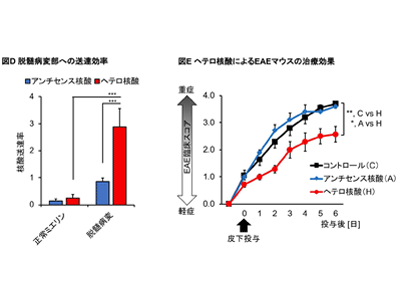
そこで、EAEマウスにコレステロールリガンド結合型ヘテロ核酸を静脈内もしくは皮下投与し、送達・遺伝子発現抑制効果を従来のアンチセンス核酸と比較した。その結果、ヘテロ核酸はアンチセンス核酸に比べ、より効率的に腰髄の脱髄病変部へ送達され、さらに病変部に群がる特性をもつミクログリア・マクロファージへ多く取り込まれた。そして、これらの細胞においてヘテロ核酸は優れた標的遺伝子発現抑制効果を発揮した。
ヘテロ核酸には従来のアンチセンス核酸とは異なる送達機構があった
EAEマウスでは脱髄病変部で血液脊髄関門が破綻するにも関わらず、ヘテロ核酸がアンチセンス核酸より効率的に送達された事から、研究グループはヘテロ核酸には血液脊髄関門通過以外の送達機構が存在すると推定。多発性硬化症の病変部において、各種受容体の発現が増加することに着目し、ヘテロ核酸のコレステロールリガンドを認識する受容体候補を検索したところ、マクロファージスカベンジャーレセプター1(MSR1)がヘテロ核酸の送達機構に関与していることを特定した。
CD40遺伝子標的のヘテロ核酸を皮下投与で臨床スコアが有意に軽症化
さらに、多発性硬化症・EAEマウスのミクログリア・マクロファージ上に発現し神経炎症の促進に関与するCD40遺伝子を標的とするヘテロ核酸をEAEマウスに皮下投与すると、ヘテロ核酸を投与されたEAEマウスではミクログリア・マクロファージにおけるCD40の発現が抑制され、臨床スコアが有意に軽症化した。
多発性硬化症の新規治療法を開拓する医薬技術として期待
ゲノム解析の進展により、さまざまな遺伝子の疾患への関与が明らかにされつつあり、RNAを標的とすることが可能な核酸医薬は有望な医薬技術だ。しかし、上述の通り非侵襲投与ルートを介した中枢神経疾患の治療は未だ実現化していない。研究グループは、「再発・寛解を繰り返し、慢性の経過をたどる多発性硬化症は長期治療が必要であり、優れた有効性に加えより安全な投与ルートで有害事象の少ない治療の開発が望まれ、ヘテロ核酸はこれらを可能とする医薬技術として期待できる」と、述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース






