グリア細胞の異常は、神経障害性疼痛とも関連するか
山梨大学は3月18日、神経障害性疼痛モデルマウスを用いた研究により、この慢性痛の引き金となるスイッチの役割を果たすタンパク質として「代謝型グルタミン酸受容体5(mGluR5)」を見出したと発表した。この研究は、同大医学部薬理学講座および同山梨GLIAセンターの小泉修一教授、医学部医学科5年生の檀上洋右氏らと、自然科学研究機構生理学研究所の鍋倉淳一所長、福井大学医学部の深澤有吾教授、金沢大学医薬保健研究域医学系の石川達也助教らの共同研究グループによるもの。研究成果は、「Journal of Experimental Medicine」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
痛みは大きく分類すると、急性痛と慢性痛に分けられる。神経障害性疼痛(神経因性疼痛)は難治性の慢性痛で、原因には不明点が多く残されたままだ。また神経障害性疼痛は、切り傷、擦り傷等の急性痛の治療によく用いられる非ステロイド性抗炎症薬(NSAID)と呼ばれる薬剤がほとんど効かず、さらにモルヒネ等の麻薬性鎮痛薬にも抵抗性を示す場合が多い。痛みのコントロールが大変難しいことから、一日も早い病気の原因解明と治療法開発が待たれている。
急性痛は、手や足の傷から放出された痛み物質を痛み受容体が感知して知覚神経を興奮させることで起こる。従って、痛み受容体や末梢の知覚神経そのものが治療の標的となり、実際NSAIDは痛み受容体やそのシグナルを抑制して痛みが伝わることを抑制している。神経障害性疼痛などの慢性痛は、手足等の傷、末梢神経細胞の傷等、最初の原因となった傷が治っているにもかかわらず、痛みが続いてしまう。従って、痛み受容体や知覚神経細胞よりも、それらを知覚中枢に伝える脊髄や脳の神経回路に異常が起きていると考えられる。
脳や脊髄には、1000億個もの神経細胞が存在し、これらが複雑なネットワークを構築することで、さまざまな情報を感知し、発信している。しかし最近、脳・脊髄には、神経細胞よりも多い数のグリア細胞と呼ばれる細胞が存在し、脳の情報処理・発信で重要な役割を果たしていることが明らかになってきた。また、グリア細胞が異常になることで、脳の機能に異常が起こることも明らかとなり、現在グリア細胞は、さまざまな脳の病気(精神疾患、神経変性疾患)の原因を解き明かす鍵となる細胞であるとして、多くの研究者が注目している。神経障害性疼痛などの慢性痛においてもグリア細胞が重要な役割を果たしていることが明らかにされ、特に脊髄ミクログリアの役割に多くの注目が集まっている。
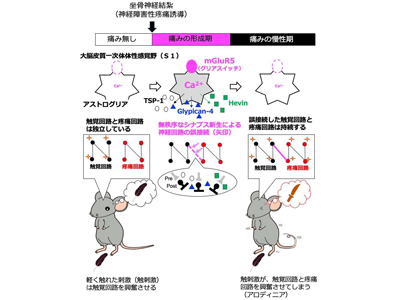
S1アストログリアの異常活動は、グルタミン酸とその受容体mGluR5により惹起される
これまでに研究グループは、神経障害性疼痛「アロディニア」を起こすモデルマウスを用いた研究で、大脳皮質一次体性感覚野(S1)のアストログリアが異常な活動性(Ca2+濃度増大)を起こすことを発見。このS1アストログリア異常活動のメカニズム解析により、これらが興奮を伝える神経伝達物質「グルタミン酸」とその受容体「代謝型グルタミン酸受容体5(mGluR5)」により惹起されていることを明らかにした。mGluR5は正常な大人のアストログリアには存在しないが、坐骨神経を結紮する等で神経障害性疼痛を発症させる処理を行うと、S1アストログリア選択的に発現してくる。
mGluR5活性化<触覚/疼痛回路の誤接続<アロディニア惹起
そこで研究グループは、mGluR5をアストログリア選択的に欠損させたマウス(mGluR5-cKO)を作成し解析を行った。その結果、mGluR5-cKOマウスではアロディニアが発症することはなかった。さらにmGluR5の活性化からどのようにアロディニアが発症するのかを調べたところ、大きく4つのことが明らかになった。1)mGluR5活性化によりS1アストログリアのCa2+シグナル上昇、2)S1アストログリアがCa2+依存的にシナプス新生因子、thrombospondin-1(TSP1)、HevinおよびGlypican-4を産生・放出、3)S1において無秩序なシナプス新生が惹起、4)本来は独立している触覚回路と疼痛回路の誤接続が起こる。これらにより神経障害性疼痛「アロディニア」が発症し、また一端誤接続されたS1の新しい回路が維持されるため、アロディニアが持続的で難治性となることが判明した。
神経障害性疼痛の直接の原因は、末梢における神経や組織が傷害されることで起こるが、強すぎたり持続しすぎたりすると、脳のS1アストログリアのグリアスイッチが入ってしまい、S1神経回路がつなぎ替えられて、本来独立している触覚回路と疼痛回路が混線してアロディニアが引き起こされる。非常に重要なことは、このようなS1神経回路の再編が、神経細胞自身により行われるのではなく、周りの細胞「アストログリア」によって引き起こされているということである。さらに、このアストログリアを神経回路再編型に変化させるスイッチがmGluR5であることが明らかになった。
シナプス再編および神経回路再編は、脳の基本原理解明においても重要な知見
シナプス再編および神経回路のつなぎ替えは、慢性痛だけでなく他の多くの脳の疾患と大きく関連している。従って、グリアスイッチmGluR5は、種々の脳疾患の病態解明にも役立つと考えられ、脳疾患研究に大きな波及効果をもたらすことが予想される。さらに、シナプス再編および神経回路再編は、脳機能の最も重要かつ基本的な基盤であることから、今回の成果が脳の基本原理解明においても重要な知見になると考えられる。「今後は、病気の時にmGluR5がアストログリアで発現してくるメカニズムを解明し、また一度誤接続してしまった神経回路を解除したり、正常化する方法の開発等を行い、治療に直結する成果、さらに神経回路再編の基本原理を解き明かす成果を発信したい」と、研究グループは述べている。
▼関連リンク
・山梨大学 プレスリリース



