脂肪細胞のRubicon、絶食時にも減少する意義は?
大阪大学は3月14日、絶食時に、脂肪細胞でオートファジーが活性化し、肝臓での脂肪蓄積とケトン体産生を促すこと、その背景にあるメカニズムを明らかにしたと発表した。この研究は、同大大学院医学系研究科の山室禎研究生(研究当時:同研究科遺伝学、現ハーバード大学博士研究員)、高等共創研究院の中村修平准教授(大学院医学系研究科遺伝学/大学院生命機能研究科細胞内膜動態研究室)、大学院生命機能研究科の吉森保教授(細胞内膜動態研究室/大学院医学系研究科遺伝学)、大学院医学系研究科の下村伊一郎教授(内分泌・代謝内科学)らの研究グループによるもの。研究成果は、「Autophagy」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
普段、脂肪細胞は余剰な栄養を取り込み、中性脂肪として自らに貯蔵している。個体が飢餓に晒されると、脂肪細胞は中性脂肪を外に放出して、サイズが小さくなる(脂肪萎縮)。放出された中性脂肪は肝臓に取り込まれ、蓄積する(肝脂肪症)。さらに、肝臓は中性脂肪を用いて、緊急時の栄養として重要なケトン体を産生する。この過程で、脂肪細胞が中性脂肪の行き先を自らから外へと変化させるステップが重要であると考えられていたが、その機構の理解は進んでいない。
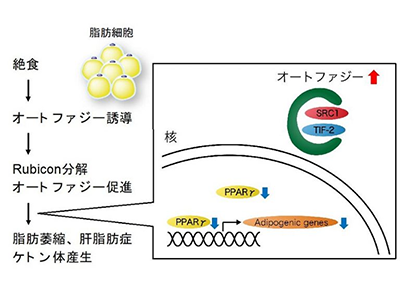
オートファジーは細胞内の分解機構であり、不要な構造物を分解することで細胞の健康を維持している。そのため、がんや神経変性疾患など、さまざまな疾患に対してオートファジーは抑制的に働くことが示されている。一方で、研究グループは2009年にオートファジー抑制因子であるRubiconを同定。老化した脂肪細胞ではRubiconが著減し、過剰なオートファジーが健康を害することを明らかにした。また、脂肪細胞のRubiconが絶食時にも減少することが見出されており、その意義は不明だった。
オートファジー上昇マウスは絶食させなくても、野生型で絶食時と同程度の脂肪組織量の減少
まず、研究グループはRubiconが絶食に伴い顕著に減少することを確認。同時に、もう一つのオートファジー抑制因子であるmTORC1が不活性化していることも見出した。そのため、絶食時に脂肪細胞のオートファジーは活性化していると考えられた。
次に、脂肪細胞でRubiconを欠損し、オートファジーが上昇したマウスの脂肪組織量を調査。その結果、野生型マウスは絶食時に顕著な脂肪組織量の減少を示すが、オートファジーが上昇したマウスは絶食させなくても、同程度の脂肪組織量の減少を示した。逆に、脂肪細胞でオートファジーを抑制したマウスは、絶食させても脂肪組織量が減少しにくいことがわかった。さらに、このマウスでは絶食時において、肝臓での脂肪蓄積と血中ケトン体の増加が顕著に抑制されていた。
これらの結果から、脂肪細胞でのオートファジー活性化が、絶食時の肝臓での脂肪蓄積とケトン体産生に重要であると考えられるという。
絶食時オートファジー誘導、抑制因子Rubicon分解でオートファジー促進
また、絶食した個体の脂肪組織では、脂肪の蓄積に重要な働きをするSRC-1、TIF2が、活性化したオートファジーによって分解されていることが判明。つまり、絶食時にオートファジーが活性化すると脂肪細胞は脂肪を蓄積できなくなり、その結果として肝臓での脂肪蓄積が進むと考えられる。
さらに、絶食時にはRubiconもオートファジーによって分解されているということが明らかになった。すなわち、絶食時にオートファジーが誘導されると、抑制因子であるRubiconが分解されて、さらにオートファジーが促進されるという仕組みがあると推測された。
これらのことから、絶食時、Rubiconの分解・減少によりオートファジーが促進され、脂肪細胞が脂肪を蓄積できなくなることで肝臓での脂肪蓄積・ケトン体産生が進むことが明らかになった。
脂肪細胞の老化は、絶食時の反応が通常時にも働くことである可能性
研究グループは先行研究により、老化に伴うオートファジー過剰が脂肪細胞での脂肪貯蔵を妨げること、その分の脂肪が肝臓に蓄積すること(脂肪肝)を突き止めていた。今回の研究結果から、この機構は本来、絶食時の肝臓での脂肪蓄積・ケトン体産生のために存在していると考えられる。つまり、脂肪細胞の老化とは、絶食時の反応が通常時にも働くことである可能性が示唆される。
絶食時にはオートファジーの活性化以外にもさまざまな機構が働くことが知られているため、今回の研究を端緒として脂肪細胞老化の研究が加速されることが期待される、と研究グループは述べている。
▼関連リンク
・大阪大学医学系研究科・医学部 研究活動




