トランスポゾンによる遺伝子変異誘発技術を用いて、肝内胆管がんの治療標的を探索
日本医療研究開発機構(AMED)は3月14日、動物個体内で網羅的にがん遺伝子を探索出来る技術を用いてスクリーニングを行い、原発性肝がんの一種である肝内胆管がんの発症にTRAF3が重要な役割を果たすことを発見し、また、TRAF3のシグナル伝達経路の下流に存在するNIKが肝内胆管がんの新たな治療標的となることを証明したという研究成果を発表した。この研究は、大阪大学医学部附属病院の塩出悠登医員、同大大学院医学系研究科の小玉尚宏助教、竹原徹郎教授(消化器内科学)、米国MDアンダーソンがんセンターのニール・コープランド(Neal Copeland)教授らの研究グループによるもの。研究成果は、「HEPATOLOGY」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
肝内胆管がんは、肝内に発生する原発性肝がんの一種で、ときおり肝細胞がんも混在する混合型肝がんとして発生する場合もある。その発症頻度は低く、希少がんの一つと考えられている。非アルコール性脂肪肝炎(NASH)を含む慢性肝疾患がそのリスク因子として知られているが、発症機序には不明な点が多く、有効な治療方法も限られているため、予後の悪い疾患として知られている。これまで肝内胆管がんの治療標的を探索するために、臨床検体を用いたがんゲノムシークエンス解析が行われてきたが、同定された遺伝子異常の多くは創薬化が困難な状況であり、有効な治療方法はいまだ多くない。したがって、肝内胆管がんの発症機序の解明や治療標的の探索は重要な課題とされている。
小玉助教らの研究グループはこれまで、動物個体内で網羅的にがん遺伝子を探索できる技術を用いてさまざまながん種においてがん遺伝子を同定してきた。この技術は、変異原となるべく遺伝子改変されたトランスポゾンという「動く遺伝子」がゲノム上を多数ランダムに飛び回るマウスを用いて行う。このマウスでは、トランスポゾンの挿入先のさまざまな遺伝子に変異が生じ、その結果がん化が促進される。発症したがん細胞におけるゲノム上のトランスポゾン挿入部位を次世代シークエンサーで網羅的に解読することで、がん化に寄与した遺伝子変異をスクリーニングすることが可能となる。
研究グループは今回、肝内胆管がんのがん抑制遺伝子の一つとして知られるPTEN(ピーテン)遺伝子を肝特異的に欠損させたマウスに対して、トランスポゾンによる遺伝子変異誘発技術を適応し、研究を行った。
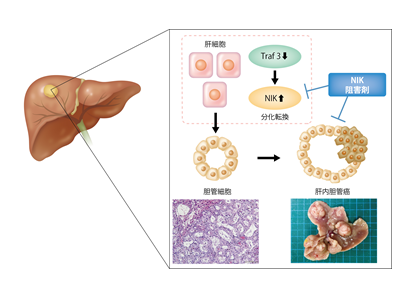
PTEN/TRAF3遺伝子の抑制により肝細胞がんから胆管細胞がんへ分化転換
研究グループは、遺伝子変異の誘発により肝内胆管がんの発症が有意に促進し、中でもTRAF3遺伝子に最も高頻度に機能欠失型の変異が入っていることを見出した。そこで肝細胞もしくは胆管細胞特異的にPTEN遺伝子とTRAF3遺伝子を欠損するマウスを作成した結果、肝細胞において欠損したマウスにおいてのみ肝全体に広がる肝内胆管の腫瘍性増殖が生じ、その後肝内胆管がんを発症することを証明した。
また、シングルセル遺伝子発現解析の結果、両遺伝子を欠損した肝細胞が増殖胆管細胞へと分化転換している可能性を見出し、肝がん細胞株を用いた検討の結果、PTEN・TRAF3遺伝子の抑制により肝細胞がんから胆管細胞がんへの分化転換が生じることを証明した。
患者がん部でTRAF3低発現/NIK高発現値例は予後不良
さらに、その責任分子としてTRAF3遺伝子のシグナル伝達経路の下流に存在するNIK遺伝子を同定し、NIKを阻害することで、肝内胆管がんの腫瘍増殖を強く抑制できることを証明。加えて、肝内胆管がん患者のがん部におけるTRAF3とNIK発現を検討し、TRAF3の発現低値例並びにNIK発現高値例は有意に予後不良となることも明らかにした。
NIKの働きを抑える治療薬の臨床応用に期待
研究により、原発性肝がんの一種である肝内胆管がんの新たな発症機構が明らかとなったことで、その高リスク群であるNASH等の慢性肝疾患患者において、肝内胆管がんの早期診断や適切なサーベイランスの確立につながることが期待される。「同定されたNIKの働きを抑える治療薬の臨床応用が進むことで、特に予後不良である肝内胆管がん患者の生命予後改善に寄与することが期待される」と、研究グループは述べている。
▼関連リンク
・日本医療研究開発機構(AMED) 成果情報



