フィロウイルスのヌクレオカプシド形成機構の解明を目指す
京都大学は3月7日、マールブルグウイルスのウイルス核タンパク質-RNA複合体の立体構造をクライオ電子顕微鏡解析により明らかにしたと発表した。この研究は、同大ウイルス・再生医科学研究所兼、同大学大学院生命科学研究科の野田岳志教授、藤田陽子同博士課程学生、京都大学白眉センターの杉田征彦特定助教、国立感染症研究所ウイルス第一部の高松由基主任研究官、北海道大学人獣共通感染症国際共同研究所の五十嵐学准教授、フィリップ大学マールブルクのStephan Becker教授らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
マールブルグウイルスはエボラウイルスと同じフィロウイルス科に属し、どちらのウイルスもヒトに対して高い致死率の出血熱を引き起こす。近年も、アフリカで散発的な流行が繰り返されており、2021年にはギニアやコンゴ民主共和国でアウトブレイクを起こしている。しかし、どちらのウイルスに対しても承認された治療薬は存在しない。
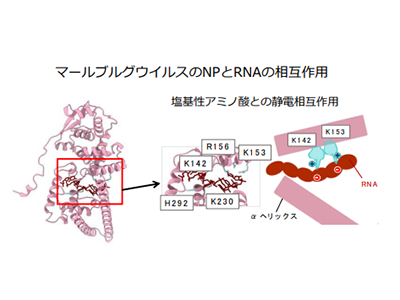
マールブルグウイルスは感染細胞内において、ウイルス遺伝子とウイルス核タンパク質から構成される螺旋状のヌクレオカプシドを形成する。ヌクレオカプシドはウイルスゲノムの転写と複製に必須の複合体であり、ウイルス増殖環で中心的な役割を担う。しかし、マールブルグウイルスのヌクレオカプシド形成機構はこれまで明らかにされていなかった。
先行研究により研究グループは、エボラウイルスのヌクレオカプシドのコア構造であるウイルス核タンパク質-RNA複合体(NP-RNA複合体)の立体構造をクライオ電子顕微鏡解析により原子レベルで明らかにした。そこで本研究では、マールブルグウイルスのNP-RNA複合体の構造解析を実施し、エボラウイルスのNP-RNA複合体と比較解析することで、フィロウイルスのヌクレオカプシド形成機構の解明を目指した。
形成に重要な相互作用、マールブルグウイルスとエボラウイルスのNP-RNA複合体構造の類似性を明らかに
マールブルグウイルスは、感染症法上、最も危険度が高い一種病原体。バイオセーフティーレベル4の実験室で扱う必要があるため、日本国内ではウイルスを使用した実験はできない。そこで本研究では、マールブルグウイルスの核タンパク質(NP:nucleoprotein)のみを細胞内で発現させ、細胞のRNAと結合したNP-RNA複合体を精製して構造解析に用いた。クライオ電子顕微鏡法を用いて、精製した螺旋状NP-RNA複合体の画像を大量に撮影し、単粒子解析によって分子構造を高分解能で決定後、その原子モデルを構築した。
その結果、マールブルグウイルスのNP-RNA複合体の構造は、エボラウイルスのNP-RNA複合体の構造と非常によく似た構造をとっていた。構築したマールブルグウイルスのNP-RNA複合体の原子モデルから、NPとRNAの結合や、隣接するNP同士の結合に重要なアミノ酸が推定された。
そこで、構造情報を元に両ウイルスのNPにアミノ酸変異を導入し、この変異NPを用いた機能解析を実施。その結果、RNAとの相互作用に重要なアミノ酸や、隣接するNPとの相互作用に重要なアミノ酸、螺旋状NP-RNA複合体の形成に重要なアミノ酸が明らかになった。これらの相互作用に重要なアミノ酸は、マールブルグウイルスとエボラウイルスのNPに共通して存在していた。
マールブルグウイルスとエボラウイルスへ広く効果を示す治療薬開発に期待
マールブルグ病とエボラウイルス病は、バイオテロや輸入感染症の観点から早急に対策を要するウイルス感染症の1つだが、これらに有効な治療薬はない。同研究では、マールブルグウイルスのNP-RNA複合体の立体構造を原子レベルで明らかにし、ウイルス増殖に必要な相互作用を明らかにした。また、エボラウイルスのNP-RNA複合体の構造と比較解析することで、ヌクレオカプシド形成に重要なアミノ酸が両ウイルスで共通することを見出した。
同研究結果により、マールブルグウイルスとエボラウイルスの両方に対して広く効果を示す治療薬開発への貢献が期待される、と研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る




