未成熟なタンパク質AIMP2がゴルジ体に蓄積しストレス応答誘導で、細胞病態生じる
東京薬科大学は2月25日、先天性大脳白質形成不全症について、未成熟なタンパク質AIMP2がゴルジ体に蓄積しストレス応答を誘導することで、細胞病態(分化阻害など)が生じることが判明したと発表した。この研究は、同大生命科学部分子神経科学研究室博士前期課程(修士課程)2年の落合愛理沙氏らの研究グループによるもの。研究成果は、「Neurochemical Research」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ヒトでは膨大な体積を有する大脳は、極めて複層的な階層からできており、それぞれの階層が多種類のニューロン(神経細胞)およびグリア細胞、その他の細胞群から構成される。神経細胞は神経信号の伝達機能を担い、グリア細胞は神経細胞を保護する役割を持つとされている。しかし、最近の研究から、グリア細胞はこのような神経細胞への補佐的な役割ばかりではなく、主体的に神経信号の伝達機能を担うことが明らかになった。
そのため、グリア細胞に異常がおきると神経細胞にも重篤な障害が生じる。そのなかに、遺伝的要因で発症するペリチェウス・メルツバッヘル病(Pelizaeus-Merzbacher disease)がある。この病気は、指定難病である先天性大脳白質形成不全症の1つとして位置付けられている。先天性大脳白質形成不全症は希少疾患でもあり、20万~50万人に1人に生じるとされている。これは、国内外で同じ頻度だ。
キャスパーゼ-2阻害で、細胞病態異常を改善
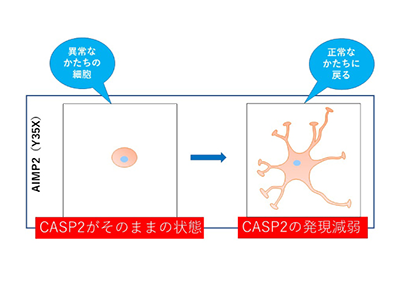
今回、研究グループはAIMP2の変異が原因で生じる先天性大脳白質形成不全症の細胞モデルを先駆けて作製。その細胞病態の原因が、まれに生じるゴルジ体ストレスであることを突き止めた。AIMP2に異常が生じると、それがゴルジ体に蓄積してグリア細胞の分化や発生に異常をもたらすと考えられるという。
一方、これらの異常はタンパク質分解酵素キャスパーゼ-2を阻害することで改善できることが明らかになった。
マウスモデルでも再現できるか検討へ
今回の研究成果は、細胞モデルの結果を中心としている。そのため、研究グループは「これらが当研究室で独自に開発した共培養システムによる人工組織でも本病態を再現できるか検討し、マウスモデルにおいても再現できるか明らかにしなければならない」と述べている。
また、前臨床試験を行い、キャスパーゼ-2の阻害剤やRNA薬を用いて治療効果が期待できるか検討したいとしている。
▼関連リンク
・東京薬科大学 プレスリリース




