腸管上皮細胞は、どのように病原体を認識して感染を防御するのか?
名古屋大学は2月21日、腸管上皮細胞がウィルスや毒素の侵入を感知して、感染を防御する機構を発見したと発表した。この研究は、同大医学部大学院医学系研究科消化器内科学の前田啓子病院助教が、ボストン小児病院、ハーバードメディカルスクールのLencer博士らとの共同研究として行ったもの。研究成果は、「Cell Host & Microbe」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
腸管粘膜は、ウィルスや細菌などの病原体に接しており、その最前線である腸管上皮細胞は、病原体が細胞内へ侵入することを防ぐ独自の防御機構を持っている。腸管上皮細胞の防御機構は、感染から組織を守り、腸管の恒常性を維持するために必要な機構であり、その破綻は腸管感染症、炎症性腸疾患の進展に深く関与する。しかし、腸管上皮細胞がどのように病原体の侵入を感知し、侵入を阻止するかについては、不明な点が多く残されていた。
ロタウィルス感染でPARD6Bの発現が低下
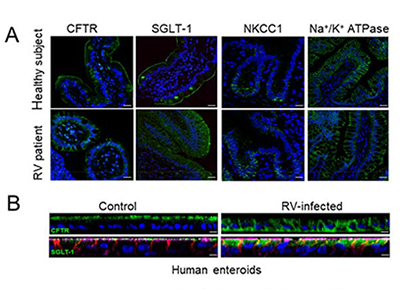
研究グループは今回、ロタウィルス腸炎患者の小腸検体において、腸管の管腔側に局在する細胞膜タンパクの局在が基底膜側に変化することに着目し、ヒトの腸管オルガノイドを用いた網羅的解析を行った。その結果、ロタウィルス感染後に発現が低下する分子「PARD6B」を同定した。PARD6Bの機能として、エンドソームの機能を促進することが同定されていることから、ロタウィルス感染において、PARD6Bの発現が低下することにより、エンドソームの機能が阻害される機構があると考えた。
PARD6B/aPKC複合体の分解を誘導するためには、スフィンゴ糖脂質との結合が必要
次に、ロタウィルス感染後のPARD6Bの発現を経時的に測定。ヒト腸管上皮細胞株や腸管オルガノイドにロタウィルスを感染させると、感染早期にPARD6B/aPKC複合体がプロテアーゼ依存性に分解されることがわかった。さらに、細胞内へは侵入せず増殖しない非活性型(viruslike particle)のロタウィルスをヒトの腸管オルガノイドに感染させたところ、活性型のロタウィルスと同程度にPARD6Bの分解を誘導した。このことから、PARD6Bはウィルスの増殖に伴って、分解が誘導されるのではなく、細胞膜への結合により、分解が誘導されることが明らかになった。
ロタウィルスは細胞膜への結合には、スフィンゴ糖脂質が必要であることが複数報告されており、細胞膜のスフィンゴ糖脂質と結合するコレラ毒素や志賀毒素を大腸上皮細胞株に感染させたところ、同様にPARD6Bの分解が誘導された。また、受容体と結合しないコレラ毒素の変異株を用いた実験では、PARD6Bの分解は誘導されなかった。このことから、スフィンゴ糖脂質との結合がPARD6B/aPKC複合体の分解を誘導するのに必要であると考えられた。
腸管上皮細胞が毒素のスフィンゴ糖脂質への結合を感知し、エンドソームの機能を阻害し感染を防御
最後に、上皮細胞はPARD6B/aPKC複合体の分解を誘導し、エンドソームの機能を阻害することにより、病原体の侵入を阻止しているのではないかと考えた。ロタウィルスを感染させてから、センダイウィルスを感染させると、PARD6Bの分解が誘導され、細胞内のセンダイウィルス量がロタウィルスを単独で感染させた群と比較して有意に減少することが判明。さらに、コレラ毒素を感染後、ロタウィルスを感染させると、同様にロタウィルスを単独で感染させた群と比較してより優位にロタウィルス量が低下した。
これらの結果から、腸管上皮細胞は、ウィルスや毒素が細胞膜のスフィンゴ糖脂質に結合すると、それを感知してPARD6B/aPKC複合体の分解を誘導し、エンドソームの機能を阻害し、その後の感染を防御するという機構を見出した。
腸管感染症、炎症性腸疾患、絨毛萎縮症の病態との関連を検討予定
研究グループは今後、同定した感染の防御機構の機序の解明や、ノックアウトマウスを用いて生体における機能を解析予定だという。また、防御機構の破綻が病因となっている腸管感染症や炎症性腸疾患、エンドサイトースの異常である絨毛萎縮症等の病態との関連を検討していく予定だとしている。
▼関連リンク
・名古屋大学 プレスリリース



