予後不良な高異型度漿液性卵巣がん、新規治療法発見のためビッグデータ解析
理化学研究所(理研)は2月7日、医療ビッグデータとコンピュータ科学を活用し、卵巣がんの新しい治療標的として、「LKB1-MARK3経路」を同定したと発表した。この研究は、理研革新知能統合研究センター目的指向基盤技術研究グループがん探索医療研究チームの町野英徳特別研究員、浜本隆二チームリーダー、小松正明副チームリーダー、浅田健研究員、国立がん研究センター研究所の金子修三ユニット長、同中央病院婦人腫瘍科の加藤友康科長、病理診断科の吉田裕医員、東京大学医学部附属病院の曾根献文講師、織田克利教授、大須賀穣教授らの国際共同研究グループによるもの。研究成果は、「Communications Biology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
「高異型度漿液性卵巣がん」は卵巣がんによる死亡者数の70~80%を占める、最も予後の悪い婦人科系悪性腫瘍。近年のゲノム解析の結果、高異型度漿液性卵巣がんのほぼ全例にがん抑制遺伝子TP53の不活性化型変異が認められ、染色体不安定性によるゲノム構造の異常が広汎に引き起こされていることがわかっている。このうち、約半数には相同組換え修復経路の分子に発現変化・機能異常が認められ、PARP阻害剤が有効な治療法とされているが、残りの約半数の症例に対する治療標的は十分には確立していない。
また、高異型度漿液性卵巣がんは、ゲノムの点突然変異の頻度が低い一方で、染色体不安定性によるコピー数変化が頻繁に生じていることがわかっている。そのため、個別の遺伝子変異に注目した従来型の研究手法では、これ以上新しい治療標的を発見できない可能性がある。そこで国際共同研究グループは、さまざまなアルゴリズムを用いてコンピュータで解析する「ビックデータ解析」に基づき、遺伝子発現量の変化を定量的に評価する必要があると考え、研究を開始した。
MARK3遺伝子発現低下が臨床予後の悪化に関連と判明
国際共同研究グループは、高異型度漿液性卵巣がんのがん組織と正常卵巣組織の遺伝子発現量を比較解析するために、大規模なマイクロアレイデータ、RNA-seqデータ、臨床情報などが含まれる複数のデータベースの統合解析を実施。遺伝子発現変化が臨床予後に影響する遺伝子を抽出するために、新しい解析プラットフォームを構築した。その結果、「LKB1-MARK3経路」のMARK3遺伝子が高異型度漿液性卵巣がんで発現抑制されており、その遺伝子発現量の低下が臨床予後の悪化に関わることが判明した。
タンパク質MARK3は、AMPK関連キナーゼ(リン酸化酵素)に分類されるセリンスレオニンキナーゼであり、タンパク質LKB1から直接リン酸化修飾を受けることでキナーゼとしての機能が活性化することが知られていたが、LKB1-MARK3経路の卵巣がんにおける異常については報告されていなかった。
ビックデータ解析の結果を臨床医学的に検証するために、高異型度漿液性卵巣がんの正常組織(卵管上皮細胞)と前がん病変(上皮内がん)、浸潤がんの患者由来検体を用いて、LKB1とMARK3のタンパク質発現量を評価した。その結果、正常組織ではLKB1とMARK3がいずれも発現している一方、前がん病変(上皮内がん)でLKB1の発現が低下し、浸潤がんでMARK3の発現が低下することがわかった。
MARK3<CDC25Bの323Serをリン酸化<核内移行阻害<G2/M期停止を誘導
次に、MARK3の機能を解析するために、卵巣がん細胞株(OVCAR3)にMARK3を強制発現させた際の影響をRNA-seqを用いて評価した。KEGGパスウェイ解析の結果、MARK3の強制発現によって細胞周期の経路に関わる遺伝子群の発現量が低下することがわかった。
そこで、MARK3が細胞周期に影響を与える機序を解明するために、リン酸化モチーフ解析により、MARK3がキナーゼとしてリン酸化修飾をする対象となる新しい基質を探索。その結果、興味深いことに、MARK3が細胞周期のG2/M期移行をつかさどるCDC25Bをリン酸化修飾する可能性が示されたため、キナーゼアッセイで検証した。結果、確かにMARK3がCDC25Bの323番目のセリンを直接リン酸化することがわかった。機能的に、MARK3はCDC25Bの323番目のセリンをリン酸化することで、CDC25Bの核内移行を阻害し、細胞周期のG2/M期停止を誘導する役割を持つと考えられた。
LKB1-MARK3経路は、タンパク質合成経路に関わる代謝性ストレス応答性の細胞周期チェックポイント
このCDC25ファミリーをリン酸化するMARK3の機能は、細胞がDNA損傷を受けた際にCDC25ファミリーをリン酸化して細胞周期停止を誘導する、CHEK1などのDNA損傷応答性の細胞周期チェックポイントキナーゼの機能と類似していた。
そこで、「MARK3も何らかの細胞ストレスに応答して細胞周期を調整する細胞周期チェックポイントキナーゼである」という仮説を立て、さまざまなストレス誘導物質を反応させた際のMARK3活性化の有無を評価した。その結果、タンパク質合成阻害剤であるアニソマイシンや、不良タンパク質の蓄積状態を模倣する小胞体ストレス誘導物質であるタプシガルギンと反応させたときに、MARK3が活性化することが明らかになった。興味深いことに、CHEK1に代表されるDNA損傷応答性チェックポイントキナーゼを活性化させるDNA損傷誘導物質と反応させたときには、MARK3は活性化しなかった。
また、MARK3遺伝子の上流にあるLKB1遺伝子をノックダウンしたところ、アニソマイシンによるMARK3の活性化は起こらなかった。さらに、MARK3遺伝子をノックアウトした細胞株に対しては、アニソマイシンとタプシガルギンの抗腫瘍効果が高まることが示されました。以上から、LKB1-MARK3経路はタンパク質合成経路に関わる代謝性ストレスに応答する「細胞周期チェックポイント」であると考えられた。
MARK3の強制発現による抗腫瘍効果を卵巣がん細胞とマウスで確認
MARK3による細胞への影響をさらに詳しく解明するために、網羅的クロマチン構造解析法であるATAC-seqを用いて、卵巣がん細胞株(OVCAR3)にMARK3を強制発現させた際のクロマチン構造情報を取得し、転写因子モチーフ解析を実施。その結果、MARK3の強制発現によって、JUNやFOSなどから構成されるAP-1複合体のDNA結合活性が低下することが示唆され、ウェスタンブロッティング法でもJUNのリン酸化修飾が減弱することが示された。
また、AP-1複合体はHippoシグナル伝達の転写因子と相互作用することが報告されていたが、今回取得したRNA-seqデータの結果も、MARK3の強制発現によってHippoシグナル伝達の標的遺伝子の発現量が低下することを示していた。以上から、MARK3は卵巣がん細胞株においてAP-1複合体とHippoシグナル伝達の標的遺伝子を発現抑制することによって抗腫瘍効果を発揮すると考えられた。
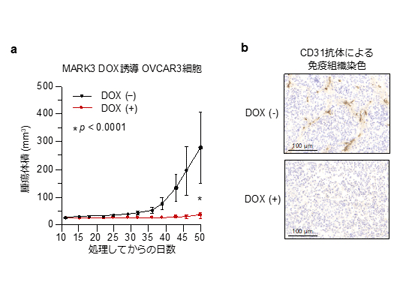
最後に、マウスの皮下組織にMARK3を強制発現させた卵巣がん細胞株(OVCAR3)を移植したところ、コントロール群と比較して有意に腫瘍形成と血管新生が阻害され、MARK3が生体内においても強力な抗腫瘍効果を持つことが明らかになった。
LKB1-MARK3経路はがんの新しい治療標的として有望
今回の研究では、理研革新知能統合研究センターが保持する先導的な情報科学技術を用いて医療ビッグデータを解析し、従来の医学研究手法でその結果を検証した。この成果は、がん研究においても情報科学と医学が融合した学際的な研究手法が重要であることを示している。
卵巣がんは婦人科系悪性腫瘍の中で最も死亡者数の多いがん種であり、有効な治療法の開発が強く求められている。今回の研究では、正常組織とがん組織の遺伝子発現情報に着目したビッグデータ解析手法を導入することによって、今まで知られていなかった卵巣がんにおけるLKB1-MARK3経路の機能異常を同定することに成功した。今回のビッグデータ解析手法は、異なるがん種や疾患の原因探索にも応用できる可能性がある。
また、今回の研究では、LKB1-MARK3経路がタンパク質合成経路に関わる代謝性ストレスに応答する細胞周期チェックポイントであることを世界に先駆けて報告した。「ストレス応答性チェックポイントが機能異常に陥っているがんは細胞ストレスに対して脆弱になり、予後が悪化する傾向にあるため、今後、LKB1-MARK3経路はがんの新しい治療標的としてますます重要視される可能性がある」と、研究グループは考えている。
▼関連リンク
・理化学研究所 研究成果




