双極細胞形成関連遺伝子を欠失したヒトES細胞で、機能性の高い網膜組織を作れるか?
理化学研究所(理研)は1月21日、特定の遺伝子を欠失させたヒトES細胞から網膜組織を分化誘導して移植に用いることにより、理想に近い生着を可能にする網膜組織を作製できることを明らかにしたと発表した。この研究は、理研生命機能科学研究センター網膜再生医療研究開発プロジェクトの万代道子副プロジェクトリーダー(理研創薬・医療技術基盤プログラムプロジェクトリーダー)、山﨑優客員研究員(研究当時、現大日本住友製薬株式会社再生・細胞医薬神戸センター主任研究員)、大日本住友製薬株式会社再生・細胞医薬神戸センターの桑原篤グループマネージャーらの共同研究グループによるもの。研究成果は、「iScience」オンライン版に掲載されている。
画像はリリースより
網膜は、光を感じて伝達する複数種の神経細胞(ニューロン)と、それを支える網膜色素上皮細胞で構成された複雑な組織。眼に入ってきた光の刺激は、まず一次ニューロンである視細胞(桿体視細胞と錐体視細胞)が受容し、電気信号に変換される。この電気信号は、二次ニューロンの双極細胞に伝達され、三次ニューロンの神経節細胞を介して脳に届けられる。これらの細胞はそれぞれが層を形成し、網膜は全体として多層構造となっている。
網膜変性疾患は遺伝子の異常により、まず桿体視細胞が正常な機能を失い変性することで減少し、進行すると中心視野を担う錐体視細胞も徐々に減少し、視力低下や失明に至る。一度視細胞が失われてしまうと既存の手法では治療できない。そこで、多能性幹細胞から網膜の細胞や組織を分化誘導して移植する再生医療に期待が寄せられている。視機能の再生医療のための移植手法には、網膜組織を分散して視細胞のみ純化した液体(細胞懸濁液)を移植する方法と、網膜シート(網膜組織)を移植する方法がある。細胞懸濁液移植は、視細胞が移植先の双極細胞と直接接触するためシナプスが形成されやすいという利点が考えられるが、形態的な成熟や長期の生着は難しいとされている。
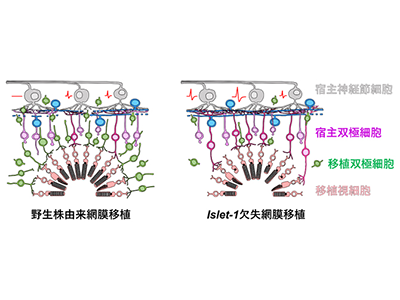
これに対して万代道子副プロジェクトリーダーらはこれまで、胎生期に相当する未熟な網膜シートを移植すると、視細胞が移植先で層構造を形成しながら成熟し、安定的に長期間にわたって生着することや、免疫原性が低いなどの利点があることを報告してきた。一方で、移植網膜の中に残存する双極細胞が移植視細胞と宿主双極細胞とのシナプス形成を阻み、網膜シートの視機能再生効果を最大化できていない可能性が示されている。治療法として細胞懸濁液移植と網膜シート移植のどちらが適切であるかは、疾患の進行状態などでも左右されるため、それぞれの利点を生かしつつ、課題を克服する技術の開発が重要だ。
万代副プロジェクトリーダーらは先行研究において、双極細胞の運命付けや成熟に関与するIslet-1などの遺伝子を欠失したマウスES細胞やマウスiPS細胞を用いた移植実験を行った。その結果、遺伝子を欠失させた移植後網膜は、成熟すると対照群(野生株)と比べて移植組織由来の双極細胞が減少し、宿主双極細胞と移植視細胞のシナプス形成が促進され、末期網膜変性モデルマウスの視機能がより効率よく改善できる可能性が示された。共同研究グループは今回、これをさらに発展させ、ヒトのES細胞で双極細胞の形成に関わるIslet-1遺伝子を欠失させることにより、より機能性の高い網膜組織を作製できるかを検証した。
双極細胞が減少し、移植視細胞と宿主双極細胞との間で機能的なシナプスが形成されやすく
まず、Islet-1遺伝子を欠失させたヒトES細胞の網膜組織への分化誘導を試みた。すると、Islet-1遺伝子欠失ヒトES細胞由来の網膜組織は、培養初期においてはIslet-1遺伝子の発現が見られないこと以外、Islet-1遺伝子を持つヒトES細胞(野生株)由来の網膜組織と変わりない形態を示したが、長期培養後(分化後240日)に双極細胞が減少することを確認した。
そこで、分化後60日(ヒト胎生期60日目の網膜に相当)の未熟なIslet-1遺伝子欠失ヒトES細胞由来の網膜組織を、視細胞がほとんど消失している末期網膜変性モデルラットに移植した。移植時点では、Islet-1遺伝子欠失ヒトES細胞由来と、Islet-1遺伝子を持つヒトES細胞(野生株)由来の移植網膜に形態的な違いはほとんどなかった。しかし移植後、分化が始まってから200日を超え、組織が成熟すると、Islet-1遺伝子欠失ヒトES細胞由来網膜では明らかな双極細胞の減少が見られた。
また、Islet-1遺伝子欠失ヒトES細胞由来の網膜組織移植では、宿主双極細胞の軸索が移植視細胞に突起を伸ばしている様子が見られ、この突起の末端を詳細に調べると、移植視細胞の前シナプスマーカーと宿主双極細胞側の後シナプスマーカーの共局在が観察された。これらの結果は、移植した網膜組織中の双極細胞が減少し、移植視細胞と宿主双極細胞との間で機能的なシナプスが形成されやすくなったことを示しているという。
Islet-1遺伝子を欠失した多能性幹細胞を用いることで理想に近い網膜組織として生着可能
次に、Islet-1遺伝子の欠失が視機能の再生につながるかを検証するため、宿主の神経節細胞の光応答を調べた。多電極アレイシステムと呼ばれる手法で電気生理学的な解析を行ったところ、移植視細胞に当てた光に対する宿主の神経節細胞の反応率は、Islet-1遺伝子欠失ヒトES細胞由来の網膜組織移植が最も高く、次いでIslet-1遺伝子を持つヒトES細胞(野生株)由来の網膜移植、移植なしの網膜、という結果になった。また、光反応率の高い網膜組織の組織学的特徴を調べたところ、移植視細胞と宿主双極細胞の接触率の高さや、網膜の内層構造の維持が光反応率と相関していた。これらは、Islet-1遺伝子欠失ヒトES細胞由来の網膜組織を移植した場合の特徴であり、機能的な優位性とも関係していることが示された。
以上の結果から、胎生期相当の未熟な網膜組織を移植する従来の方法に加え、双極細胞の形成に関わる遺伝子を欠失した多能性幹細胞を用いるという2つの工夫により、移植後の網膜細胞の分化を制御し、最終的に、より理想に近い網膜組織として生着させられることが明らかになった。
技術を発展させ、臨床応用可能な網膜組織移植法の確立を目指す
これまで国内の研究グループは、網膜変性疾患に対する再生医療の臨床研究として、滲出型加齢黄斑変性に対する自家iPS細胞由来網膜色素上皮シートの移植および他家iPS細胞由来網膜色素上皮細胞懸濁液の移植、網膜色素上皮不全症に対する他家iPS細胞由来網膜色素上皮細胞懸濁液移植を行ってきた。また、神戸市立神戸アイセンター病院は、網膜色素変性に対し、大日本住友製薬が製造した他家iPS細胞由来網膜シート(網膜組織)の移植(2020年)を行った。これらはいずれも、正常な遺伝子型を持つヒトiPS細胞を用いて、治療法の安全性や有用性の検証のために実施されたものだ。
「本研究では、移植に用いるヒト多能性幹細胞を遺伝子改変することで、より機能性の高い網膜組織を作製できることを示した。今後、この技術をさらに発展させ、臨床応用可能な網膜組織移植法の確立を目指す」と、研究グループは述べている。
▼関連リンク
・理化学研究所 研究成果(プレスリリース)




