広島大学発マイクロRNA創薬のファースト・イン・ヒューマン試験
広島大学は1月20日、核酸医薬MIRX002の治験を計画し、悪性胸膜中皮腫を対象とした医師主導治験(第1相)において、1例目の被験者にMIRX002の投与を行ったと発表した。この治験は、同大原爆放射線医科学研究所腫瘍外科の岡田守人教授(責任医師)が計画したもので、MIRX002は、同大学院医系科学研究科細胞分子生物学研究室の田原栄俊教授らの研究グループが開発したもの。
画像はリリースより
「MIRX002」は、天然型マイクロRNA(miR-3140-3p)を薬効成分としている。田原栄俊教授が、これまでの基礎研究を通して開発してきた創薬シーズを臨床応用したもので、広島大学で基礎研究からファースト・イン・ヒューマン試験によるヒトへの投与に至った初めての事例だ。
アスベストが主要な原因、発症からの余命は約1年
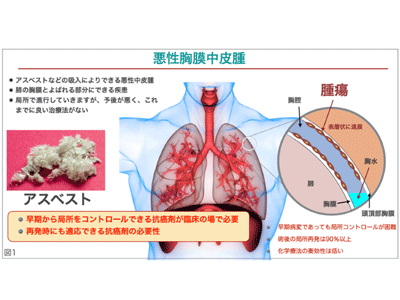
悪性中皮腫は、胸膜、腹膜、心膜、精巣鞘膜に発生する悪性腫瘍であり、胸膜が80~85%、腹膜が10~15%、その他の部位での発生は1%以下とされる。発症原因としては、70~80%の症例においてアスベスト曝露との関連性が疫学的に証明されている。日本では1980年代半ばまでアスベストの輸入が行われていた。アスベスト曝露開始から発症までの潜伏期間が25~50年とされていることから、日本における今後の悪性中皮腫の発生ピークは2030年頃で、罹患者数は年間3,000人に及ぶと予測されている。また悪性中皮腫による死亡者数も2000年の710人から、2005年911人、2010年1,209人、2015年1,504人と確実に増加の一途をたどっており、2039年までの累計死亡者数は10万人を超えると予測されている。2018年時点で世界では、年間約3万870人が罹患し、2万6,278人が死亡しているとのデータがまとめられている。罹患者のうち、88.8%が北米、欧州、アジアで罹患しており、中でも欧州が世界全体の44.2%、アジアが同31.5%と突出している。このように悪性胸膜中皮腫は、既存の治療法では十分な治療効果が得られず、発症してからの余命が約1年とされる、難治性がんの一つで、延命・根治が出来る革新的な治療薬開発が期待されている。
がん幹細胞・抗がん剤耐性がん細胞を抑制、多様な抗腫瘍スペクトル
MIRX002核酸医薬は、ヒトの体内で合成される天然型のマイクロRNA核酸を用いた核酸医薬製剤。がんでの遺伝子異常により発現が低下したマイクロRNAを補充することにより、がんの増殖やがんの根幹細胞として知られている「がん幹細胞」などを抑制し顕著な効果を示す抗がん剤である点を特徴とする。MIRX002は、マイクロRNAと界面活性剤ペプチド「A6K」(株式会社スリー・ディー・マトリックスにより開発)を組み合わせたもので、投与時に調整して胸腔内に局所投与する。「A6K」は、マイクロRNAの分解保護とがん細胞への伝達を効率化させる界面活性剤ペプチドで、同社は治験薬として株式会社PURMX Therapeuticsに独占的にライセンス提供している。
MIRX002は、悪性胸膜中皮腫だけでなく乳がん、すい臓がん、食道がん、頭頸部がん、卵巣がんなど多様な抗腫瘍スペクトルを示すもので、将来的には悪性胸膜中皮腫のみならず多くのがん治療に貢献できる可能性がある。特に、MIRX002は、がん細胞を根絶させるために必要といわれている、「がん幹細胞」や「抗がん剤耐性がん細胞」の双方に顕著な抗腫瘍効果を示す。同薬剤の標的遺伝子の特定と腫瘍増殖抑制メカニズムの検討がなされ、正常細胞とがん細胞を明確に区別できる作用機序であることを明らかにしており、MIRX002副作用リスクも極めて少ないと考えられる。
安全性および忍容性の評価と、推奨用量の決定が目的
今回の医師主導治験は、悪性胸膜中皮腫の患者を対象として胸腔内にMIRX002を投与するものであり、安全性および忍容性を評価し、推奨用量を決定することを目的とした第1相試験。世界で初めて人に投与するファースト・イン・ヒューマン試験であり、悪性胸膜中皮腫への有効性については探索的に検証する。
田原教授らの研究成果で悪性胸膜中皮腫のモデルマウスを用いた結果では、顕著な腫瘍の縮小と延命効果が見られている。動物を用いた非臨床試験での安全性、有効性などの試験を終了し、ヒトでの安全性を評価する第1相試験を開始した。「同治験において、安全性と認容性が確認出来れば、アスベストが原因となる悪性胸膜中皮腫の治療方法を一変させる画期的な治療薬として、悪性胸膜中皮腫の腫瘍抑制および再発防止にもつながることが期待される」と、研究グループは述べている。
なお、今回の医師主導治験は日本医療研究開発機構(AMED)「橋渡し研究プログラム」のシーズCに採択(2021年度〜2023年度)されており、広島大学病院広島臨床研究開発支援センターが治験の支援を担当している。さらに、橋渡し研究支援拠点である北海道大学拠点がAROとしてデータマネジメント業務、統計解析業務を担当している。これまでに同研究は、AMED「橋渡し研究戦略的推進プログラム」のシーズB(2017~2019年度)、preC(2020年度)として採択されており、橋渡し研究支援拠点である北海道大学拠点の支援を受けて実施した研究成果の実用化を行ってきたものを発展させたものとなる。PURMX Therapeuticは、治験薬(薬効成分miR-3140-3p)の規格の担保、治験薬製造に係る手順書に基づく原薬および治験薬の製造管理を行い、核酸治験薬の提供を行っている。
▼関連リンク
・広島大学 研究成果



