腸管恒常性維持や感染制御に関わるパネート細胞、分化や機能制御メカニズムは?
東京大学医科学研究所は1月19日、糖鎖を指標としてパネート細胞を機能的に分類し、その分化や機能制御について解析したところ、腸内細菌と免疫細胞由来サイトカインがパネート細胞サブセットの分化・機能を制御していることを見出したと発表した。この研究は、同研究所粘膜免疫学部門の神岡真理子特任研究員と清野宏特任教授らの研究グループが、千葉大学の後藤義幸准教授、倉島洋介准教授、北海道大学の中村公則准教授、綾部時芳教授らとの共同研究として行ったもの。研究成果は、「Proceedings of the National Academy of Sciences of the United States of America」オンライン版に掲載されている。
画像はリリースより
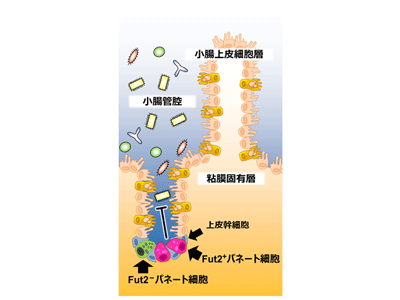
腸管は上皮細胞層を介して膨大な数の食餌成分や細菌、ウイルスといった外来抗原に常に暴露されており、消化機能を担うだけではなく病原微生物や有害物質に対する第一線の生体バリアとして機能する。小腸では細長い絨毛構造が連なっており、その底の部分にあたる陰窩基底部には上皮細胞の一種であるパネート細胞と上皮幹細胞が局在している。
パネート細胞はEGF、Dll4、Wnt3などの幹細胞増殖因子を分泌し上皮幹細胞ニッチを形成することで、各種上皮細胞の発達と維持に貢献している。さらにパネート細胞は抗菌ペプチドを分泌することで正常な腸内細菌叢の維持および病原体に対する自然免疫による感染防御機能の一端を担う。パネート細胞の抗菌ペプチドは大きく発達した細胞内顆粒に含まれ、その大きさや形はパネート細胞の感染防御機能を評価する指標となる。このようにパネート細胞は腸管恒常性の維持に大きく貢献し、その分化および機能発現制御メカニズムの理解は健康的な腸内環境の構築・維持や腸管関連疾患の新規予防・治療法の確立につながる可能性を秘めているが、いまだ不明な点が多くある。
フコシル化に関わるFut2を発現/非発現のパネート細胞サブセットがあった
研究グループはこれまでに、腸内細菌との共生環境構築と感染防御に重要な腸管上皮細胞層を構成する「絨毛円柱上皮細胞」における糖鎖の付加(フコシル化)に着目し研究を展開してきた。絨毛円柱上皮細胞のフコシル化を担う2型フコース糖転移酵素遺伝子(Fut2)の発現は、自然免疫細胞の一種である3型自然リンパ球(ILC3)が腸内細菌の刺激により産生するサイトカインIL-22に誘導されることを明らかにした。一方、腸管上皮細胞層を構成するもう一つの主要細胞である「パネート細胞」のフコシル化の生物学的意義やその発現誘導メカニズムは不明だった。そこで今回の研究では、パネート細胞におけるFut2発現の検討に始まりその発現メカニズムに着目し、パネート細胞の分化および機能制御メカニズムの解明を目指した。
腸管においてフコシル化はFut1およびFut2が担うことから、野生型マウス、Fut1欠損マウス、およびFut2欠損マウスのパネート細胞におけるフコース発現を、UEA-1レクチンを用いて免疫組織学的に観察。その結果、野生型マウス、およびFut2欠損マウスのすべてのパネート細胞ではフコースが観察された。これにより、すべてのパネート細胞のフコシル化はFut1が制御することがわかった。しかしながら、Fut1欠損マウスにおいても一部のパネート細胞でフコースが観察された。このことから、一部のパネート細胞ではFut1に加えてFut2もフコシル化を制御することがわかった。さらに、Fut2遺伝子発現を直接的に確認出来るFut2LacZ/+マウスの小腸組織切片をLacZ染色することでパネート細胞のFut2の発現を確認し、Fut2発現パネート細胞(Fut2+パネート細胞)と非発現パネート細胞のサブセットが存在することを明らかにした。
Fut2によるフコシル化はパネート細胞の顆粒分泌を制御
次にパネート細胞内顆粒に結合する蛍光プローブZinpyr-1とフコース特異的に結合するレクチンUEA-1を用いたフローサイトメトリー法を駆使して、パネート細胞サブセットを比較検討した。その結果、Fut2+パネート細胞は感染防御に重要な抗菌ペプチドを内包する細胞内顆粒を豊富に有する事から、感染防御に深く関わることが示唆された。Fut2のパネート細胞における役割を検討するためにFut2欠損マウスと野生型マウスを比較解析したところ、Fut2欠損マウスのパネート細胞内顆粒は異常形態を示し、糞便中のパネート細胞特異的抗菌ペプチドであるαディフェンシン量が有意に減少していた。さらにマウス腸管オルガノイドを作製し、パネート細胞の顆粒分泌の様子を観察したところ、野生型マウスと比較してFut2欠損マウス由来では顆粒放出の割合が減少していた。以上の結果から、Fut2によるフコシル化はパネート細胞の顆粒分泌を制御することが示された。
Fut2発現サブセットは腸内細菌刺激とIL-22依存的
小腸におけるFut2+パネート細胞の局在を調べたところ、その多くが十二指腸ではなく回腸に局在していた。回腸には十二指腸と比較して腸内細菌が豊富に存在することを考慮し、Fut2+パネート細胞の分化と腸内細菌の関与を検討。腸内細菌を消失させるため抗生物質を経口投与したところ、Fut2+パネート細胞は消失した。続いてILC3から腸内細菌依存的に産生されるサイトカインIL-22の関与を検討するため、IL-22欠損マウスを解析したところ、Fut2+パネート細胞の消失が認められた。これらの結果からFut2+パネート細胞は腸内細菌刺激およびIL-22依存的なサブセットであることもわかった。
パネート細胞は獲得免疫細胞とIL-17aの制御を受ける
さらに宿主免疫細胞によるパネート細胞制御について詳細に検討するため、獲得免疫に関わるT細胞およびB細胞を欠損するRag1欠損マウスを解析。その結果、Rag1欠損マウスの糞便αディフェンシン濃度は、野生型マウスと比較して有意に減少していた。IL-17a欠損マウスの糞便でも、αディフェンシンの濃度が減少していた。以上から、パネート細胞は獲得免疫細胞およびIL-17aの制御を受けることがわかった。
パネート細胞は腸管における恒常性維持と感染防御に関わり、その異常はクローン病を始めとする腸管関連疾患発症や易感染性との関与が知られている。「今回見出したパネート細胞サブセットの存在とその誘導・制御機構についての成果は、病態形成機構のさらなる解明とそれに基づく新規の予防・治療法開発研究に結びつく事が期待される」と、研究グループは述べている。
▼関連リンク
・東京大学医科学研究所 プレスリリース




