ALS患者の運動神経細胞、TDP-43凝集体はどう形成される?
新潟大学は1月17日、筋萎縮性側索硬化症(ALS)の主要な原因遺伝子TDP-43について、ストレスにさらされた細胞ではUSP10タンパク質とG3BP1タンパク質がTDP-43に結合し、異常なTDP-43凝集体の形成を抑制することを発見したと発表した。この研究は、同大大学院医歯学総合研究科ウイルス学分野の髙橋雅彦准教授、藤井雅寛教授らの研究グループによるもの。研究成果は、「Molecular and Cellular Biology誌」オンライン速報版に掲載されている。
画像はリリースより
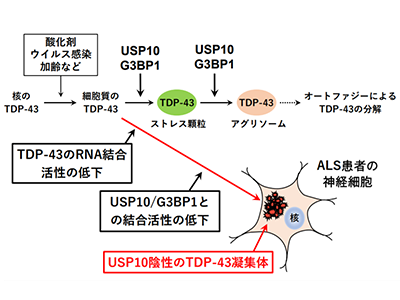
ALSは、運動神経細胞の細胞死を特徴とする致死性の神経変性疾患。ALSの主要な原因遺伝子TDP-43は、ALSの運動神経細胞の細胞質で異常なタンパク質凝集体を形成し、このTDP-43凝集体が神経細胞に細胞死を引き起こしてALSを発症させる。しかし、ALS患者の運動神経細胞で、TDP-43凝集体がどのように形成されるのかは不明だ。
細胞質のTDP-43、2つのタンパク質USP10とG3BP1に結合
定常状態において、TDP-43は細胞の核に局在している。今回の研究により、プロテアソーム阻害剤の処理など細胞にストレスを加えると、TDP-43の一部が細胞質に移動すると判明。TDP-43は、まずストレス顆粒に、次いでアグリソームに局在したという。アグリソームに局在したTDP-43は、オートファジーによって分解されることが報告されている。
細胞質のTDP-43は、USP10とG3BP1の2つのタンパク質に結合し、ストレス顆粒とアグリソームに局在していた。また、TDP-43がUSP10/G3BP1に結合するためには、TDP-43がRNAに結合することが必要で、RNAに結合できないTDP-43の変異体は、USP10/G3BP1に結合できないことがわかった。
ALSのTDP-43<RNA結合活性低下<USP10/G3BP1と結合不能<病的な凝集体形成
RNA/USP10/G3BP1に結合できないTDP43の変異体は、細胞質で異常なUSP10陰性の凝集体を形成した。さらに、USP10の発現を低下させた場合も、TDP-43は細胞質内で不溶性の凝集体を形成したとしている。
一方、ALS患者の神経細胞では、TDP-43凝集体のほとんどにUSP10が含まれていなかった。ALS患者では、TDP43のRNA結合活性が低下していることが報告されている。したがって、今回の研究は、ALS患者のTDP-43は、RNA結合活性が低下し、USP10/G3BP1と結合できないために、病的なTDP-43凝集体を形成していることを示唆しているという。
USP10活性化剤が治療薬として有望な可能性
日本でのALS患者数はおよそ1万人。現在のところ、ALSに対して効果的な治療薬は開発されていない。研究グループは、同研究について、USP10の活性化剤が治療薬として有望であることを示している、としている。
また、研究グループは今後、USP10を活性化する薬剤の開発を進めていくという。さらに、ALS以外の神経変性疾患においても、病原性タンパク質の凝集にUSP10が関与しているかどうかを解析する予定だ。
▼関連リンク
・新潟大学 ニュース




