P2Y6Rの「IBDの病態」に対する役割は?
九州大学は1月12日、ブロッコリースプラウトなどの緑黄色野菜に多く含まれるスルフォラファンやイベリンが細胞膜表面にある炎症誘導性のGタンパク質共役型受容体「P2Y6R」と結合し、細胞内への取り込みと分解を促進することで、炎症を抑制することを明らかにしたと発表した。この研究は、同大大学院薬学研究院の西田基宏教授(生理学研究所・生命創成探究センター教授兼務)と西山和宏講師、生理学研究所(生命創成探究センター)、東北大学、筑波大学、大阪府立大学、東京工業大学、東京大学との共同研究グループによるもの。研究成果は、「Science Signaling」オンライン版に掲載されている。
画像はリリースより
クローン病や潰瘍性大腸炎に代表される炎症性腸疾患(IBD)は、寛解と再燃を繰り返す腸管の慢性炎症を特徴とする原因不明の難治性の疾患。最新の統計では、クローン病患者数は約7万人、潰瘍性大腸炎患者数は約22万人と推定されており、日本でも増加傾向が続いている。IBDは、腸内細菌や食生活などの環境要因、遺伝要因、体内の免疫異常が重なって発症すると考えられている。
Gタンパク質共役型受容体(GPCR)は、さまざまな生理機能や疾患形成に関わる膜タンパク質。研究グループはこれまでに、GPCRの1種であるプリン作動性受容体P2Y6Rが加齢依存的に発現増加し、高血圧や心不全の発症に寄与することを報告している。IBD患者でもP2Y6Rの発現上昇が報告されていたが、IBDの病態に対する役割は不明だった。
P2Y6RがIBDの病態形成の増悪因子であると判明
研究グループは今回、IBDモデルであるデキストラン硫酸ナトリウム(DSS)誘発性大腸炎とP2Y6R欠損マウスを用いた検討より、P2Y6R欠損マウスでは野生型マウスと比較して、大腸炎の進行が抑制されていたことを明らかにした。つまり、P2Y6RがIBDの病態形成の増悪因子であることが明らかになった。
スルフォラファンがP2Y6Rと結合し、細胞内への取り込みと分解を促進して炎症を抑制
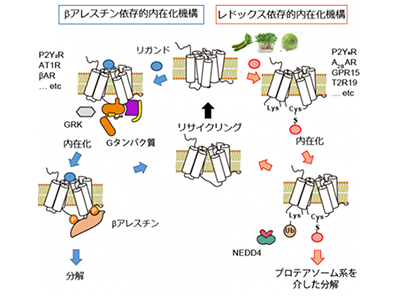
さらに、P2Y6Rを阻害する化合物を探索したところ、機能性食品(ブロッコリースプラウト)に含まれるスルフォラファンなどのイソチオシアネート化合物(ITCs)が、P2Y6Rの内在化およびプロテアソーム系分解を介して阻害することを見出した。GPCRの細胞内取り込み機構に関しては、βアレスチンを介する経路が発見されており、いくつかのGPCRは、βアレスチン感受性が低いことも明らかにされていた。
同研究では、βアレスチン低感受性のP2Y6Rを用いて、ITCがP2Y6Rの細胞内第3ループにあるシステイン(Cys220)のSH基と結合することで、第2ループのリジン(Lys137)のユビキチン化が誘導されることを明らかにした。P2Y6RのCys220をセリンに置換した変異体マウス(C220S)では、野生型マウスと比較して、反対に大腸炎の進行が促進された。さらに、Cys修飾によるLysユビキチン化を介した内在化・分解機構(redoxdependent alternative internalization:REDAI)は、P2Y6R以外のGPCRでも保存されていることが確認されたとしている。
REDAIシステムを利用した治療法・医薬品開発が健康長寿社会の実現への貢献に期待
今回の研究により、過剰なP2Y6Rの発現によるシグナルの増加がIBD病態を進行させる可能性が示された。さらに、機能性食品に含まれるスルフォラファンなどがREDAIシステムを介してP2Y6Rを分解し、炎症を抑制することも明らかにされた。
「本研究成果により、これまでのGPCRの制御機構とは全く異なった新奇内在化機構の存在が明らかになった。GPCRは大腸炎をはじめ、心不全や高血圧などさまざまな疾患制御に関連するため、REDAIシステムを利用した治療法・医薬品開発が健康長寿社会の実現に大きく貢献するものと期待される。また、農学や歯学、環境医学などとの異分野連携・融合にも発展する可能性が期待される 」と、研究グループは述べている。
▼関連リンク
・九州大学 研究成果



