移植された細胞は脊髄組織内でどのように機能しているか
慶應義塾大学は1月12日、脊髄損傷マウスに対するヒトiPS細胞由来神経幹/前駆細胞移植における、移植細胞から分化したニューロンの機能を「DREADDs」と呼ばれる人工受容体技術を用いて初めて解明したと発表した。この研究は、同大医学部生理学教室の岡野栄之教授、整形外科学教室の中村雅也教授、北川剛裕助教、名越慈人専任講師らを中心とした研究グループによるもの。研究成果は、「Stem Cell Reports」オンライン版に掲載されている。
画像はリリースより
脊髄損傷は、交通事故などの外傷を契機として、脊髄実質に強い外力が加わり障害が生じることで、運動・知覚・自立神経のまひを呈する病態だ。日本では、年間約5,000人の新規脊髄損傷患者が発生し、累計患者数は20万人以上に達している。脊髄損傷による神経系細胞の障害・損失は一般的に不可逆的であるとされ、いまだに確立した治療法は存在していない。
研究グループは、失われた神経系細胞を補うことで脊髄損傷からの回復を目指す神経幹/前駆細胞移植治療について研究を重ねてきた。京都大学iPS細胞研究所と連携した研究を行うことでヒトiPS細胞から神経幹/前駆細胞を樹立することに成功し、この細胞移植治療は臨床応用に至る段階まで進んでいる。この移植治療の脊髄損傷に対する有効性はこれまでに多く報告されてきた一方、生着した神経系細胞が生体内でどのように機能しているかはいまだ明確に解明されていない。移植された細胞は脊髄組織内でニューロン、アストロサイト、オリゴデンドロサイトを中心に分化・生着することで、さまざまなメカニズムを介して脊髄損傷から運動機能の改善に導くと予想されている。
抑制型の人工受容体DREADDsを用いて評価
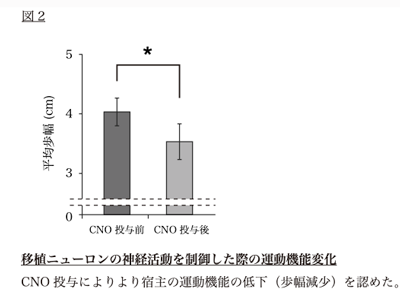
今回の研究では「DREADDs(Designer Receptors Exclusively Activated by Designer Drugs)」と呼ばれる人工受容体を用いて、移植した細胞から分化したニューロンの神経活動を特異的かつ可逆的に制御することで、移植細胞の神経活動が運動機能にどのように関与しているか評価した。
近年開発されたDREADDsは、生体内にある受容体を遺伝子改変した人工受容体で、本来はヒトには薬理作用を持たないCNO(clozapine N-oxide)に反応し、細胞にさまざまな効果を及ぼすことができる。この遺伝子を目的の細胞に発現させることで、目的の細胞のみを操作できるツールとして注目を集めている。同研究ではDREADDsの中で、移植細胞の神経活動を抑制することができるhM4Diが使用された。
移植細胞由来ニューロンの神経活動のみ特異的に抑制、脊髄損傷マウスの運動機能が低下
ヒトiPS細胞由来神経幹/前駆細胞にあらかじめ神経活動を抑制する人工受容体の遺伝子を導入した。人工受容体を発現したニューロンは培養環境において、この受容体作用により神経活動抑制を生じることが確認された。この神経幹/前駆細胞を移植した脊髄損傷マウスで、運動機能が改善した後に、人工受容体の作用を用いて移植細胞由来ニューロンの神経活動のみを特異的に抑制したところ、マウスの運動機能が一時的に低下した。
このことから、生着した移植細胞から分化したニューロンはマウスの神経回路に組み込まれ、運動機能の改善の一役を担っていることが示された。
「この治療の大きな特徴でもある、失われた神経系細胞を補填することの有効性を示した今回の研究は、移植治療の臨床応用に進めるにあたり重要な結果である。移植細胞由来ニューロンの機能を向上させることが治療効果を高める可能性を示した意味でも今後の研究につながる大きな結果となった」と、研究グループは述べている。
▼関連リンク
・慶應義塾大学 プレスリリース






