Tregに高発現のCCR4をターゲットとしたATLLとPTCLの分子標的薬
国立がん研究センターは12月24日、血液がんの治療に使用される分子標的薬の抗CCR4モノクローナル抗体(モガムリズマブ)を、固形がん患者に対しては規定の投与量より減らし適正化することで、新たな免疫療法(併用療法)として治療の奏効が期待できることを見出したと発表した。この研究は、同センター研究所と大阪大学、名古屋大学、愛知医科大学などの共同研究グループにほるもの。研究成果は、Nature Communications」に掲載されている。
画像はリリースより
今回の研究は、基礎研究の結果などから新たながん免疫療法の標的として注目されている制御性T細胞に着目して行われたもの。制御性T細胞は免疫応答を抑える機能を持ち、自己免疫疾患、炎症性疾患、アレルギー疾患などの過剰な免疫応答を抑制しているが、がん細胞はこの制御性T細胞を活性化することで免疫応答を抑制し、免疫細胞からの攻撃を回避していると考えられている。実際、悪性黒色腫や肺がんなどの多くのがんで、制御性T細胞が活性化していることがわかっている。しかし、制御性T細胞は、過剰な免疫応答を抑制し、免疫系を安定させる(免疫恒常性を維持する)重要な細胞でもあるため、がんに対する免疫応答を高めるために、免疫抑制機能のみを選択的に制御する必要があり、開発を困難にしていた。
研究グループは先行研究で、がん組織に存在する制御性T細胞にはCCR4が高発現しており、CCR4に対する抗CCR4モノクローナル抗体(モガムリズマブ)を投与することで、制御性T細胞を選択的に除去できる可能性を報告していた。モガムリズマブはCCR4を発現している成人T細胞白血病/リンパ腫(ATLL)および末梢性T細胞リンパ腫(PTCL)に対する「分子標的薬」としてすでに薬事承認され、日常診療で使用されている。
固形がん対象のP1試験実施、Tregは減少したが抗腫瘍効果は限定的
今回、研究グループは、進行・再発固形がんを対象にモガムリズマブの安全性、薬物動態、制御性T細胞の除去効果を検討する第I(Ia/b)相臨床試験を実施し、免疫モニタリングを行い、治療効果との関連を調べた。
その結果、モガムリズマブの投与により末梢血中の制御性T細胞が減少していることが確認されたが、抗腫瘍効果は限定的だった。一方で、モガムリズマブ投与により長期生存が得られた患者では腫瘍縮小をもたらすセントラルメモリーCD8陽性T細胞が多く存在していることが明らかになった。
セントラルメモリーCD8陽性T細胞もCCR4を発現しており除去されていた
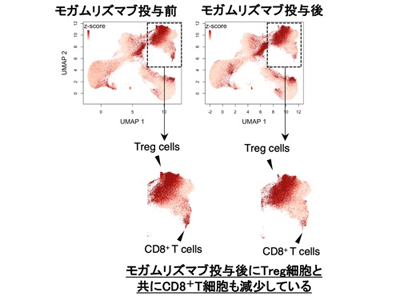
そこで、制御性T細胞の除去効果と治療効果の解離の原因や、セントラルメモリーCD8陽性T細胞との関連を明らかにするため、第Ib相臨床試験に参加した進行性固形がん患者39名の末梢血検体を用いて抗体投与前後の網羅的な免疫モニタリング(マルチカラーフローサイトメトリー/マストサイトメトリー(CyTOF))を実施。その結果、第Ia相臨床試験と同様に末梢血中の制御性T細胞は効率的に除去されおり、さらにCD8陽性T細胞の一部も同時に除去されていることが判明した。
さらに詳細な制御性T細胞の変化についてマルチカラーフローサイトメトリーを用いて検討したところ、最も免疫抑制活性を有しCCR4を高発現している活性化型制御性T細胞が有意に除去されていた。また、マスサイトメトリーにより明らかになったCD8陽性T細胞の除去は、セントラルメモリーCD8陽性T細胞の減少であることが明らかになった。セントラルメモリーCD8陽性T細胞は、近年臨床応用が進む免疫チェックポイント阻害剤治療や免疫細胞治療で腫瘍縮小をもたらす上で重要な働きがあることが明らかになっており、モガムリズマブの投与によりセントラルメモリーCD8陽性T細胞が予期せず除去されてしまったことが、治療効果が認められない原因であることが示唆された。また、CCR4の発現を調べたところ、制御性T細胞と同様に、セントラルメモリーCD8陽性T細胞も低いながらCCR4を発現していた。
投与量を減らせばTregが選択的に除去され治療奏功につながる可能性
次に、モガムリズマブの投与量の最適化について検討するため、過去の臨床試験で用いられた健康人の末梢血の薬物動態データに基づいて、生体内濃度を反映したモガムリズマブ濃度の抗体投与量の最適化を検討した。
モガムリズマブをT細胞リンパ腫での臨床用量である10µg/ml(=生体内濃度:1.0mg/kg)で添加した場合、制御性T細胞とセントラルメモリーCD8陽性T細胞の両者が有意に除去された。これに対し、1µg/ml未満(生体内濃度:0.1mg/kg未満)の場合では、セントラルメモリーCD8陽性T細胞に比較して、制御性T細胞が選択的に除去された。これは、制御性T細胞のCCR4発現がセントラルメモリーCD8陽性T細胞に比べて高いため、選択的にモガムリズマブの標的となったと考えられた。以上より、CCR4を発現しているセントラルメモリーCD8陽性T細胞の低下が、固形がん患者におけるモガムリズマブの限定的な臨床効果の一因である可能性が強く示唆された。
モガムリズマブは抗体のFc領域のオリゴ糖がフコース糖単位を持たないように改変され(脱フコース化)、通常の抗体に比べて抗体依存性細胞傷害活性が飛躍的に強くなるように設計されている。そのため、ナチュラルキラー(NK)細胞機能が臨床効果に関与している可能性も考えられる。そこでナチュラルキラー細胞の活性化状態を検討したところ、長期生存が得られた患者ではナチュラルキラー細胞が疲弊状態にあった。これにより抗体依存性細胞傷害活性が低下することで、CCR4を高発現している制御性T細胞がセントラルメモリーCD8陽性T細胞に比べて選択的にモガムリズマブの標的となり、セントラルメモリーCD8陽性T細胞が温存され長期生存につながったと考えられた。
以上より、モガムリズマブの投与量を減らすことにより、抗腫瘍免疫応答を抑制する制御性T細胞を選択的に除去しながら、腫瘍縮小をもたらすセントラルメモリーCD8陽性T細胞は維持することができ、治療の奏効につながる可能性が示唆された。
分子標的薬とがん免疫療法の至適投与量を考える上で重要な知見
今回の研究は、成人ATLLおよびPTCLに対する「分子標的薬」として承認されているモガムリズマブを、固形がんに対して制御性T細胞標的治療=「がん免疫療法」として使用するものだった。がん免疫療法として用いた場合、標的細胞の生体内の頻度が少ないことから「分子標的薬としての用量」は「がん免疫療法としては過剰量」であることが強く示唆された。特に、分子標的薬としての用量を使用することにより制御性T細胞の減少と共にCCR4分子を低発現するセントラルメモリーCD8陽性T細胞も除去され、本来薬剤の持つがん免疫療法としてのポテンシャルを発揮することができず臨床効果も限定的だった。
今回、がん免疫療法としてのモガムリズマブの至適投与量を慎重に検討することの重要性が提言された。研究グループは引き続き、臨床応用に向けて固形がんに対する大規模臨床試験の実施を目指すとしている。また、「分子標的薬として実績のある薬剤をがん免疫療法として適切・安全に使用するための治療法の開発は喫緊の課題であり、社会的意義の大きな研究成果になると考えられる」と、述べている。
▼関連リンク
・国立がん研究センター プレスリリース



