術後標本、マウスモデルではIPMNからの発がんプロセスの検証は困難
東京大学医学部附属病院は12月23日、患者由来の生きた膵管内乳頭粘液性腫瘍(IPMN)培養モデルを世界に先駆けて構築し、先進的なゲノム・エピゲノム解析を統合駆使することで、IPMNが進展する初期段階から特有のエピゲノム制御機構が疾患を形成していること、その責任分子としてMNX1、HNF1Bを同定し、IPMNの新たな治療標的となる可能性があることを発見したと発表した。この研究は、同院消化器内科の加藤裕之特任臨床医、東京大学医学部消化器内科学の立石敬介講師、同大の小池和彦名誉教授、藤城光弘教授らの研究グループによるもの。研究成果は、「Gastroenterology」オンライン版に掲載されている。
画像はリリースより
IPMNは健診などで膵のう胞(液体が貯留した病変)として偶然見つかる膵臓がんのリスクとなる病変であり、近年患者数が増えている。IPMNが見つかっても手術以外の方法でがん化を予防する術は確立されておらず、IPMNの腫瘍進展プロセスの理解が必要とされている。
これまでIPMNの研究は、手術後の固定標本を用いて検討が行われてきた。しかしこの手法のみでは、保存に伴う検体の劣化や必要量の観点から、近年急速に発展している最先端のゲノム・エピゲノム解析技術を最大限活用し、複合的に適用することが困難だった。また、IPMNにはマウスモデルが報告されているが、このモデルでは患者のIPMN特有の生きた情報、すなわち腫瘍発生から発がんに至る真のプロセスの理解や、発見した治療方法を実際に検証することが困難だった。
患者由来のIPMNの培養モデルの樹立に成功
研究グループは患者由来のIPMNの培養モデルを樹立することから取り組んだ。患者同意のもと、診断の際に採取したごく微量の細胞や、手術により切除された腫瘍のごく一部を生きたまま培養することに成功した。この技術はオルガノイド培養と呼ばれ、元の患者の疾患の特徴をよく記憶することから、近年さまざまな病態解明に応用されている。世界に先駆けて数症例のIPMNからオルガノイドを樹立することに成功し、研究グループが樹立したオルガノイドは、患者の腫瘍の特徴や抗がん剤の感受性を忠実に再現していることがわかった。
IPMNやIPMNからの発がんで、他の消化器臓器のエピゲノムの獲得という異常が関与
続いて、集積したIPMNオルガノイドライブラリを膵臓がんや正常がんの培養モデルと比較検討することで、IPMNとその後のがんとしての特徴を明確化した。IPMNの特徴として、胃や腸などの消化器系譜の特徴を模倣しながら成長するという点がある。その機構は不明だったが、研究グループは細胞の運命を司るエピゲノムにこそIPMNの本質を見出せる可能性があると考え、検証した。
近年、エピゲノムを網羅的に解析できるATAC-seqという技術が疾患の病態解明に有用と報告されている。このATAC-seqは保存された組織標本などには用いることが困難な解析手法だが、今回樹立した生きた培養モデルを用いることで、世界で初めてIPMNやIPMN由来の膵臓がんのエピゲノムの特徴を解析することに成功した。その結果、IPMNやIPMNからの発がんには、膵臓では本来見られない他の消化器臓器のエピゲノムの獲得という異常が関与していることを見出した。
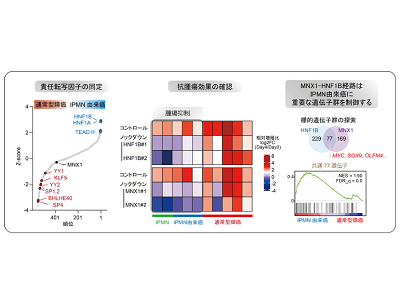
エピゲノム異常の責任分子としてMNX1とHNF1Bを同定
研究グループは、さらに詳細にデータを解析することで、このエピゲノム異常の責任分子としてMNX1とHNF1Bという消化器臓器の発生に重要な転写因子が協調して関与している可能性を見出した。これら転写因子に対するノックダウン実験やCRISPR干渉実験などの遺伝子操作を行うことでMNX1やHNF1Bを治療標的とすると、実際にIPMNやIPMN由来のがんに顕著な腫瘍抑制効果を示すこと、IPMN由来がん特有のエピゲノム制御や代表的遺伝子発現に寄与していることなどの重要性が確認された。
今回研究グループはIPMNをエピゲノムから解き明かすというコンセプトを世界に先駆けて提唱した。ゲノムの変化(=遺伝子変異)は不可逆的ではあるが、エピゲノムは可逆的でもある。「今回蓄積したIPMNのエピゲノムデータにより、IPMNからの発がんの予防やがん化の早期発見、がん化後の最適な治療法の提案につながることが期待される」と、研究グループは述べている。
▼関連リンク
・東京大学医学部附属病院 プレスリリース



