リンパ球はアンチセンス核酸やsiRNAの取り込みが悪い
東京医科歯科大学は12月22日、従来のアンチセンス核酸では導入効率が低かったリンパ球に対して、ヘテロ核酸を用いることにより、全身投与で高効率な細胞内取り込みと内在性遺伝子発現の抑制に成功したと発表した。この研究は、同大大学院医歯学総合研究科脳神経病態学分野(脳神経内科)の横田隆徳教授、永田哲也プロジェクト准教授、大谷木正貴大学院生らの研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
核酸医薬は、従来の低分子化合物や抗体医薬では困難な標的RNAの選択的制御を可能とする先端的なバイオ医薬技術。この3年ほどで脊髄性筋萎縮症、家族性アミロイドポリニューロパチーやデュシェンヌ型筋ジストロフィーなどの神経・筋疾患ですでに核酸医薬が承認されている。これ以外にも、筋萎縮性側索硬化症・パーキンソン病・アルツハイマー病等、多くの中枢神経疾患で臨床試験が進行している。
一方で、リンパ球を標的とした疾患、特に自己免疫疾患に対しては開発が進んでいない。リンパ球は、生体内での核酸(アンチセンス核酸やsiRNA)の取り込みが悪いため、血中に循環しているリンパ球内の遺伝子制御は非常に非効率的だった。そこで研究グループは、ヘテロ核酸を用いてリンパ球の内因性遺伝子の発現抑制研究に着手した。
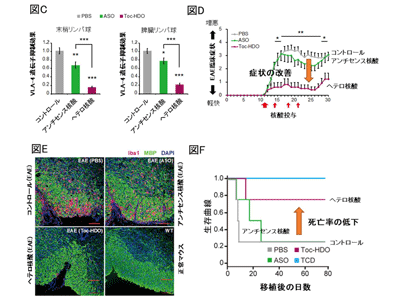
DNA/RNAヘテロ2本鎖核酸、EAE・GVHDマウスに効果を確認
研究グループは、従来の核酸医薬に比し、異なる分子構造、多様なデリバリー分子、独自の細胞内作用メカニズムを持ち、高い有効性を示すDNA/RNAヘテロ2本鎖核酸を独自に開発し、リンパ球に対して、その効果を検証した。マウスの静脈内にヘテロ核酸を投与すると、より長く血中に滞留し、末梢血液中のリンパ球における標的RNAをアンチセンス核酸(ASO)と比較して劇的に抑制した。
さらにT細胞が血液脳関門(BBB)を通過する際に利用する接着分子リガンドであるα4β1インテグリン(very late antigen (VLA)-4)を標的として、多発性硬化症モデルである実験的自己免疫性脳脊髄炎(EAE)マウスに対して、その効果を検証した。発症前投与では、有意な発症の遅延が観察され、組織学的にも炎症細胞浸潤や髄鞘の脱落(脱髄)の改善が見られた。また、発症後投与においても、EAE臨床症状の有意な改善を認めた。同じく発症機序にVLA-4の関与が報告されている移植片対宿主病(GVHD)モデルにおいても、脾臓由来T細胞をヘテロ核酸で処理した後に骨髄細胞とともに移植したところ、生存曲線の改善を認めた。
ヘテロ核酸は導入試薬を使わずにリンパ球内在遺伝子制御可能
一方、各種阻害剤で核酸の細胞内取り込みを検討したところ、ASOと比較してヘテロ核酸に特有の取り込み機構があることが示唆された。加えて、採血で体内から取り出したリンパ球に対し、特に導入試薬を使わずにヘテロ核酸を作用させることで内在性遺伝子制御が可能となった。今後、体内からリンパ球を体外に取り出して遺伝子制御を行った上で、体内に戻す治療方開発の可能性も出てきた。
自己免疫疾患から感染症、がんまで幅広い応用に期待
これまで、核酸医薬は、抗体と違い細胞内mRNAなどを標的とすることが可能であることから、次世代の医薬品として期待されていた。実際、代謝性疾患や神経・筋疾患で上市や開発が進んでいたが、リンパ球の遺伝子制御を目的とした医薬品の開発は進んでいなかった。
リンパ球の遺伝子が制御可能となれば多くの疾患が治療可能となる。研究グループは、「今回の報告で示した、多発性硬化症・臓器移植における拒絶反応や、他の自己免疫疾患、全身性エリテマトーデス、炎症性腸疾患(IBD)、関節リウマチ等に加えて、リンパ球性白血病、難治性ウイルス性疾患、悪性腫瘍に対する免疫治療など広範な疾患に対する適応が期待できる」と、述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



