CRISPR-Cas9用いて、ゲノムワイドな機能的スクリーニングを施行
北海道大学は12月20日、成人T細胞性白血病/リンパ腫(Adult T-cell leukemia/lymphoma:ATLL)の新規治療開発に成功したと発表した。この研究は、同大大学院医学研究院血液内科学教室の石尾崇研究員、中川雅夫助教らの研究グループによるもの。研究成果は、「Blood誌」にオンライン掲載されている。
画像はリリースより
ATLLは、human T-cell leukemia virus type 1(HTLV-1)感染者の一部に発症する悪性リンパ腫。既存の化学療法に対する奏功が乏しい予後不良の疾患だ。次世代シークエンスを用いたゲノム異常の網羅的解析によって、ATLLの病態に寄与する様々な遺伝子変異やシグナル伝達経路が同定されている。しかし、変異を伴う遺伝子が治療標的になり得るかは別の問題であり、腫瘍の増殖や生存に関わる機能的なタンパク質を遺伝子の変異の有無により取捨選択することなく網羅的に解析することで、これまで見出されてこなかった新規治療標的分子を見出せる可能性があると考えられてきた。
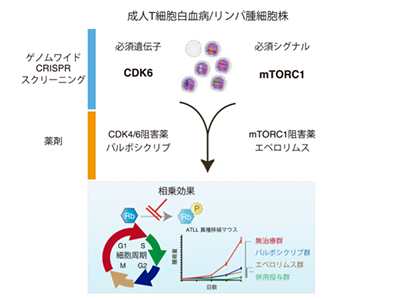
今回、研究グループは、効果の高い新規治療標的遺伝子を同定するために、ゲノム編集技術CRISPR-Cas9をATLL細胞株に用いることで、一度に約2万種類の遺伝子を網羅的にノックアウトさせ、ゲノムワイドな機能的スクリーニングを施行。具体的な方法として、ATLLの細胞株と対照群のマントル細胞リンパ腫の細胞株に対して1万9,114種類の遺伝子に対する単鎖ガイドRNA(sgRNA)を導入した。
導入された細胞を4週間継代培養した後にゲノムDNAを抽出し、ゲノムDNA上のsgRNA配列をPCRで増幅、世代シークエンサーで検出。計測されたsgRNA数から、培養前と培養後の比を計算することで、どの遺伝子がATLLの治療標的として適しているかを検討した。
TP53異常を有するATLL、パルボシクリブ単独投与の効果は限定的
研究の結果、細胞周期機構に関わるCyclin dependent kinase 6(CDK6)がATLLの増殖と生存に必須の働きをする重要遺伝子であることを見出した。
さらに、CDK4/6阻害薬パルボシクリブがATLL細胞株のRbタンパクのリン酸化を抑制して細胞周期進行の抑制とアポトーシスを引き起こし、生存と増殖を抑制することを証明。一方、TP53異常を有する場合はパルボシクリブ単独投与の効果は限定的であることもわかった。
ATLL異種移植マウスモデルへの併用投与、合併症の増加なく腫瘍量を有意に縮小
上記のメカニズムを克服する治療法を開発するために、スクリーニングのデータをATLLのみに絞り、細胞全般に必須の遺伝子であるcore fitness geneを含めたATLLに必須の遺伝子シグナルを再解析。その結果、ATLL細胞の増殖・生存はmTORC1経路(RPS6、EIF4E、mTOR、RPTOR、mLST8)に高度に依存していることを見出した。
そして、ATLL細胞株に対してパルボシクリブとmTORC1阻害薬エベロリムスを併用投与した結果、Rbタンパクのリン酸化を著明に抑制することがわかり、TP53異常の有無に関わらず極めて高い相乗効果を認めることを証明した。
研究グループは、ATLL患者からの腫瘍細胞でも同併用投与の有用性を示し、さらにATLL異種移植マウスモデルでも同併用投与により合併症の増加なく腫瘍量を有意に縮小させることに成功した。
ATLLや他の悪性腫瘍への波及効果に期待
今回の研究では、ゲノムワイドのCRISPR-Cas9ライブラリースクリーニングを用いて遺伝子に変異の見られないCDK6がATLLに特異的な必須遺伝子であることを同定し、CDK4/6阻害薬のパルボシクリブを用いることで治療標的となり得ることを見出した。
また、ATLL細胞の増殖生存はmTORC1経路に高度に依存性であることを同定し、パルボシクリブとmTORC1阻害薬のエベロリムスの併用投与はTP53異常の有無に関わらずATLL細胞に対して高い治療効果を示す可能性があると考えられた。
今回の研究の結果は、ATLLのみならず他の悪性腫瘍にも波及効果が期待でき、臨床応用への展開が期待される、と研究グループは述べている。
▼関連リンク
・北海道大学 プレスリリース




