広範囲の骨格筋にゲノム編集が必要な筋ジス、AAVベクターでは繰り返し投与できない
京都大学iPS細胞研究所(CiRA)は12月8日、ゲノム編集治療に利用可能な脂質ナノ粒子(LNP)輸送システムを開発し、筋ジストロフィーモデルマウスにゲノム編集治療を行うことに成功したと発表した。この研究は、武田薬品工業株式会社リサーチ、T-CiRAディスカバリーの見城江利也主任研究員、穂積裕幸主任研究員、犬飼直人リサーチマネージャー、京都大学CiRA、T-CiRA共同研究プログラムの堀田秋津講師らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
デュシェンヌ型筋ジストロフィーは、筋肉で働くジストロフィンタンパク質が欠損することによって発症する、進行性の重篤な筋疾患難病。患者はジストロフィン遺伝子の一部に変異が起こることが原因で、ジストロフィンタンパク質がうまく作れない状態になっているため、ジストロフィンタンパク質を作れるようにする(回復する)ためのゲノム編集治療が期待されている。これまでにCiRAの堀田講師らのグループでは、デュシェンヌ型筋ジストロフィーの患者から樹立したiPS細胞を利用して、ゲノム編集治療を目指した研究を進めてきた。
患者の体内でゲノム編集を行うためには、ゲノム編集を行う酵素であるCRISPR-Cas9を細胞内に送り届けるシステムが必要となる。これまで、AAVベクターがよく用いられてきたが、この方法では中和抗体ができてしまうため、繰り返しゲノム編集を行うことができず、デュシェンヌ型筋ジストロフィーにおいて症状がみられるような、全身の広範囲の骨格筋にゲノム編集を行うことは困難だった。そこで堀田講師らは、T-CiRA共同研究プログラムにおいてLNPに着目し、デュシェンヌ型筋ジストロフィーの治療に必要なCRISPR-Cas9を広範囲の筋肉組織に送り届ける方法の開発を試みた。
LNP-CRISPRを開発、単回投与で効果が1年持続し繰り返し投与可能
はじめに、ルシフェラーゼのmRNAを用いて、マウス骨格筋にmRNAを送達できるLNP組成を探索。ここで見出したLNPにゲノム編集を行うにあたって必要なCas9 mRNAとガイドRNAを搭載したところ(LNP-CRISPR)、骨格筋で効率よくゲノム編集が起こることを確認した。
患者由来iPS細胞を用いて最適化した、ヒト遺伝子配列を認識するガイドRNAをマウスで検討するために、マウスジストロフィン遺伝子の一部分をヒト遺伝子配列に置き換えた、筋ジストロフィーモデルマウス(hEx45KI-mdx44)を準備した。このマウス骨格筋に、ジストロフィン遺伝子のmRNAに作用する核酸医薬(ASO: antisense oligo)を一回投与した場合、ジストロフィンタンパク質の回復効果は1か月程度しか持続しなかった。一方、LNP-CRISPRの場合、一回の投与でジストロフィンタンパク質の回復効果が12か月に渡って継続していることが確認できた。
次に、目的のゲノム編集が起こった際に、ルシフェラーゼが働いて光る仕組みをもたせたマウスに、複数回投与の実験を実施。新規開発したLNP-CRISPRと従来型のAAV-CRISPRをマウスの片脚にそれぞれ1回投与した28日後に、反対側の脚へ2回目の投与を行った。その結果、LNPでは1回目、2回目ともにルシフェラーゼの反応が見られゲノム編集活性を確認できたが、AAV-CRISPRでは2回目に投与した部分での反応が見られなかった。これにより、LNPは繰り返し利用し、ゲノム編集を起こすことができることが確認できた。
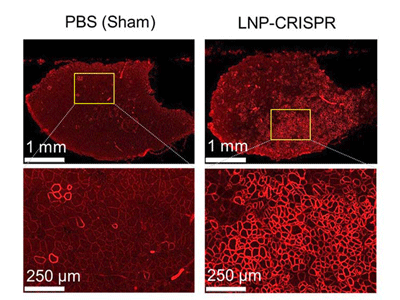
筋ジスモデルマウスの治療に成功、灌流投与で広範囲にゲノム編集
筋ジストロフィーモデルマウス(hEx45KI-mdx44)に、LNP-CRISPRを筋肉注射で2週間かけて6回投与し、投与した部分の筋肉の様子を顕微鏡で観察した。すると、LNPを投与しなかった場合(PBS)はほとんとジストロフィンタンパク質がみられなかったが、LNP-CRISPRを投与した場合(LNP-CRISPR)は38.5%の筋線維でジストロフィンタンパク質が陽性となっていることが観察できた。
体を動かすためには複数の筋群を修復する必要がある。1回の投与で多くの筋群を修復できるように、マウスの大腿四頭筋(QD)を止血帯で縛り、足首の静脈(伏在静脈)からLNP-CRISPRを灌流投与した。前脛骨筋(TA)に筋肉注射した場合はTAでのみゲノム編集が起きていたのに対し、灌流投与をした場合は止血帯をしていたQDを除き、多くの筋肉でゲノム編集が起きていた。
ゲノム編集療法の開発に向けた重要なステップ
今回の研究で、ゲノム編集を起こすためのCRISPR-Cas9 mRNAおよびガイドRNAを骨格筋組織へ繰り返し投与可能なLNP輸送システムが開発された。筋ジストロフィーの病態がおよぶ骨格筋は体重の約4割を占め、各筋肉は筋膜によって分離されているため、ゲノム編集薬剤を1回の投与ですべての骨格筋組織に行き渡らせることは困難だ。そのため、今回のように複数回投与できる方法が必要になる。従来の薬剤であれば、時間が経つと最初に投与した効果が薄れてしまうが、ゲノム編集の場合、1年に渡って効果が持続することがわかった。このため、LNP-CRISPRを複数回投与することで徐々に治療範囲を広げていく方法が有効な可能性が期待される。
研究グループは、「有効性と安全性を確保するためにはさらなる研究と評価が必要だが、今回の研究成果は筋ジストロフィーをはじめとしたゲノム編集療法の開発に向けた重要なステップといえる」と、述べている。
▼関連リンク
・京都大学iPS細胞研究所 ニュース




