神経内分泌腫瘍と神経内分泌がんの合計115例の網羅的ゲノム解析を実施
大阪大学は12月9日、日米欧のサンプルを用いて全ゲノム解析等を行い、難治がんである消化器神経内分泌がん(NEC)の発がんメカニズムを解明したと発表した。この研究は同大大学院医学系研究科/国立がん研究センター研究所の谷内田真一教授(がんゲノム情報学)/ゲノム医科学分野長らの国際共同研究グループによるもの。研究成果は「Cancer Discovery, a journal of the American Association for Cancer Research」に掲載されている。
画像はリリースより
消化器の神経内分泌系の新生物(NENs:Neuroendocrine neoplasms)は免疫組織化学染色で、神経内分泌系のマーカーであるシナプトフィジンやクロモグラニンAが陽性となる希少な疾患。NENsは臓器横断的に発症するが、消化器、特に膵臓が主な原発臓器となっている。2010年のWHO分類では、細胞増殖の程度と核分裂像数による悪性度に応じてG1、G2、G3に分類されていた。しかし、このG3の中には予後が比較的良いものと極めて予後不良のものが混在していたため、2019年のWHO分類では、NENsをまず病理組織像により神経内分泌腫瘍(NET)と神経内分泌がん(NEC)に分類した。さらにNETを細胞増殖の程度と核分裂像数でG1、G2、G3に分類することに修正された。NECは病理組織像から、Small-cell type(小細胞型)とLarge-cell type(大細胞型)に分類された。Small-cell typeは小細胞肺がんに組織像が類似している。
NETは手術で根治することも多いことから、手術残余検体を用いた研究が進められており、これまでにMEN1などの複数の原因遺伝子が同定されている。一方NECは、極めてまれで診断時に遠隔転移を認めることが多いため手術適応患者は少なく、研究試料の入手が難しいことからこれまで大規模な網羅的ゲノム解析は行われていなかった。しかし、今回研究グループは、消化器のNETとNEC(計115症例)の網羅的ゲノム解析(全ゲノム解析、全エクソーム解析、全トランスクリプトーム解析(RNA-seq)、メチル化解析とATAC-seq解析)を行った結果、その発症メカニズムが全く異なることから、両者は別の疾患であることを実証した。
膵臓由来NECはDuctal-typeとAcinar-typeに分類でき、起源細胞が異なる可能性
NECは臓器別に膵臓由来と非膵臓消化器由来に分類して解析した。病理組織像は類似しているが、ゲノム異常は類似している点と異なる点があることが明らかになった。膵臓由来NECはTP53とRB1遺伝子の異常が特徴的で、「Ductal-type」と「Acinar-type」に分類できることも発見した。
前者はKRAS遺伝子の変異を有し、膵臓の腺管細胞マーカー遺伝子(SPP1やCFTR)の発現が上昇している。後者はKRAS変異がなく、膵臓の腺房細胞マーカーの遺伝子(PTF1A)が高発現している。「Ductal-type」のNECと「Acinar-type」のNECの違いは、膵臓におけるそれぞれの起源細胞が異なることに起因すると考えられる。「Ductal-type」は通常型膵臓がんにも高頻度に見られるKRAS変異を有することから起源細胞が共通である可能性があるが、通常型膵臓がんでみられるCDKN2AやSMAD4遺伝子の異常はほとんどないことから、早い時期に通常型膵臓がんとDuctal-type NECに方向性が分かれるのではないかと考えられた。
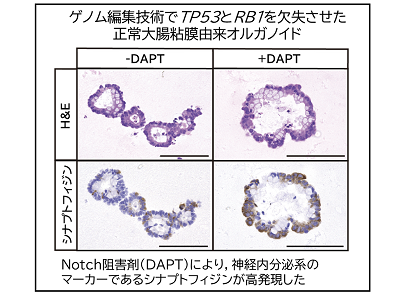
非膵臓消化器由来のNECでは、TP53とRB1遺伝子の異常、もしくは、TP53とCCNE1 or MYC遺伝子の異常(両者は相互排他的)が特徴的で、さらに構造多型が多いことが明らかとなった。非膵臓消化器由来のNECでは、Notch遺伝子ファミリーの異常も特徴的に認められた。実際に、大腸粘膜由来オルガノイドを用いてNotchシグナルの抑制が神経内分泌マーカーであるシナプトフィジン陽性細胞を誘導することを検証した。
5年生存率は、膵臓由来NECが非膵臓消化器由来NECと比較して、有意に予後不良だった。さらに胃NECと大腸NECのそれぞれの一例は、ウイルス感染が原因となってがん発生していることが明らかとなった(胃NEC:メルケル細胞ポリオーマウイルス、大腸NEC:ヒトパピローマウイルス)。このようなウイルス発がんの場合はTP53とRB1遺伝子の異常は認められなかった。
NECではプロモーターのメチル化により転写因子SOX2/ASCL1が高発現
研究グループは、NECの大きな特徴として、神経内分泌系への分化をつかさどる転写因子であるSOX2やASCL1が高発現していること、これが各遺伝子のプロモーター領域のメチル化に起因することも発見した。一般的には、プロモーター領域の脱メチル化により遺伝子の発現が増加するが、最近ではこのような逆の現象も報告されている。さらにATAC-seq解析では、SOX2の発現が高いNECにおいてSOX2周辺がオープンクロマチン構造となっている、すなわち遺伝子の転写が促進されていることを明らかにした。
NECから腺がんや扁平上皮がんになる可能性を示唆する所見
NECの病理組織では、通常の腺がんや扁平上皮がんも観察されることがあり、その成分が30%以上ある場合は、MiNEN(mixed neuroendocrine-non-neuroendocrine neoplasm)と呼ばれる。これまでMiNENの多くは腺がんや扁平上皮がんが神経内分泌系に分化してNECになると考えられてきた。しかし今回の研究において、両成分のゲノム異常を比較することで、これまでの概念を覆すような、NECにさらに遺伝子異常が蓄積し、腺がんや扁平上皮がんになる可能性を示唆する所見も観察された。
NETの発症メカニズムはNECとは全く異なることを実証
研究グループは一方で、NETはNECとは全く別のメカニズムで発症することも実証した。NETにおいては、NECの多くで観察されるRB1遺伝子の異常はみられなかった。遺伝子変異はNECと比較して少数で、変異を有する主要な遺伝子はMEN1、DAXX、VHL遺伝子だ。興味深いことに、膵臓NETの約40%で多数の染色体レベルの欠失(染色体1、2、3、6、8、10、11、15、16、21と22番)が起こっており、これらの約3分の2の症例はMEN1遺伝子の突然変異を有していた。
また、多数の染色体で欠失が起きていた症例の約2分の1の症例では、欠失の後に全ゲノム重複が起きていたこともわかった。MEN1遺伝子はMeninと呼ばれるタンパク質をコードしており、Meninは染色体の構造維持やDNA修復に関与していることが知られている。これらのことから、MEN1遺伝子変異が細胞分裂の際に染色体の分離機構を不安定にさせ、こういった現象を引き起こしたものと推察された。
加えて、NETはG1やG2からG3へと悪性度が進む過程で、TP53やCDKN2Aなどの遺伝子異常が蓄積することも解明した。
新たなサブグループを定義づけ、ドラッグ・リポジショニングや新規創薬の推進に期待
今回の研究成果により、希少かつ難治がんである消化器NECの発症・進展メカニズムが全ゲノムレベルで明らかになった。NECは、同じ臓器由来の通常型のがん(腺がんや扁平上皮がん)とは異なるゲノム異常を有し、既存の分子標的薬等の薬剤ターゲットとなる遺伝子異常が少なく、現状では難治性のがんであることもわかった。「複雑で多様な病態を詳細に解析し、発がんメカニズムに基づいて新たなサブグループを定義づけることで、開発中の分子標的薬のドラッグ・リポジショニングや新規創薬が推進されることが期待される」と、研究グループは述べている。
▼関連リンク
・大阪大学 ResOU




