喘息などの慢性アレルギー性炎症、なぜ収束することがあるのかは不明だった
かずさDNA研究所は11月9日、これまで不明とされていた喘息が収束するメカニズムを明らかにしたと発表した。この研究は、同研究所オミックス医科学研究室の遠藤裕介室長の研究グループが、東京慈恵会医科大学細菌学講座の金城雄樹教授の研究グループ、千葉大学の中山俊憲教授の研究グループと共同で行ったもの。研究成果は、「Cell Reports」に掲載されている。
画像はリリースより
アレルギー疾患は日本において国民の2人に1人が罹患しており、いわゆる国民病として位置づけられている。代表的アレルギー疾患である喘息は、下気道の頻発性気道狭窄や喘鳴などの症状で特徴づけられる慢性炎症疾患であり、世界ではおよそ2億人が罹患していると報告されている。しかし、その治療は対症療法がほとんどで、いまだに根治治療法は開発されていない。そのため治療が長期にわたり、患者の肉体的、精神的、経済的負担が極めて大きいことから、現代医学が解決すべき大きな課題のひとつとなっている。
これまでの研究から、喘息の慢性化および重症化には、ハウスダスト、花粉、カビなどの原因物質(アレルゲン)を記憶し、アレルギーを誘導する病原性記憶T細胞が関わることがわかっている。中でも、2型の病原性記憶T細胞が炎症を起こした組織で増えており、これがIL-5というサイトカインを放出して、炎症性白血球である好酸球が組織に浸潤するのを誘導する。2型病原性記憶T細胞による好酸球の誘導は、アトピーなど他の慢性アレルギー疾患でもみられることがわかっている。
一方で、喘息などの慢性アレルギー性炎症は収束していくことがある。しかし、その収束のメカニズムは、現象の複雑さや解析自体に長い時間がかかるなどの理由から研究が進んでおらず、長年不明のままだった。そこで研究グループは、気管支喘息の炎症が収束する分子メカニズムを研究した。
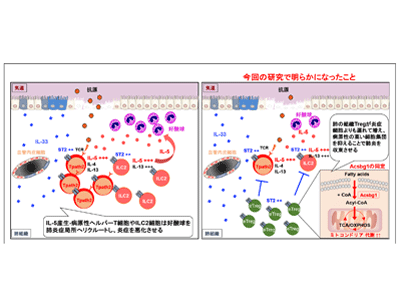
肺の炎症部位で増えたTregは脂肪酸代謝酵素「Acsbg1」を特異的に発現
以前の研究で、傷ついた組織から放出される炎症性のサイトカインであるIL-33の受容体IL-33R(ST2)が、2型病原性記憶T細胞だけでなく、逆に肺組織で炎症を抑える働きをする制御性T細胞(Treg)でも強く発現していることがわかっていた。そこで、肺組織に常在する制御性T細胞が喘息を収束させているという仮説を立て、IL-33誘導性の喘息モデルマウスを使って解析した。すると、IL-33の刺激に応じて肺組織の制御性T細胞の数は著しく増加し、その際、制御性T細胞はまわりから脂肪酸を積極的に取り込んでいた。この結果から、炎症収束における脂肪酸代謝の関係性が示唆されたので、次世代シークエンサーと高精度質量分析機器(プロテオーム)を用いたオミックス解析を実施。これにより、肺組織の制御性T細胞で特異的な発現をしている、Acsbg1という脂肪酸代謝酵素を発見した。
Acsbg1欠損マウスは喘息が収束せず、Treg移植で肺炎症が改善
そこで、CRISPR/Cas9によるゲノム編集技術を用いてAcsbg1をなくすと、肺組織の制御性T細胞でどのようなことが起こるのかを調べた。結果、Acsbg1をなくしたマウスでは、制御性T細胞の増殖能や生存能が低下しており、肺組織に常在する制御性T細胞の減少が見られた。また電子顕微鏡で細胞内部を観察すると、ミトコンドリアの数や形態に異常が認められ、細胞呼吸能も低下していた。制御性T細胞の減少は肝臓でも見られ、Acsbg1はミトコンドリア代謝を制御することで、組織常在性の制御性T細胞の数をコントロールしていることがわかった。
Acsbg1をなくしたマウスにIL-33誘導性の喘息を起こさせたところ、対照群のマウスでは喘息誘導後20日ほど経過すると徐々に肺の炎症が治るのに対し、Acsbg1をなくしたマウスでは全く炎症が治らなかった。このマウスでは肺組織の制御性T細胞が著しく減少していたので、外から正常な制御性T細胞を戻すことで炎症が治るかの実験を行った。すると予想通り、通常の制御性T細胞を戻すことで肺炎症が改善したことから、肺組織中の制御性T細胞でAcsbg1が適切に働くことにより、喘息が収束するというメカニズムが明らかになった。
Acsbg1は自己免疫性肝炎でも重要な役割を担っている可能性
今回の研究で明らかになった喘息が収束するメカニズムは、肺組織中の制御性T細胞の中でAcsbg1が適切に働くことで、肺炎症時に制御性T細胞が増殖・生存することができ、2型病原性記憶T細胞に依存した好酸球性の炎症が収束するというもの。Acsbg1は脂質代謝酵素のひとつだが、これまで代謝と免疫・炎症応答についてはあまり注目されてこなかった。組織の慢性炎症は、肥満や老化といった生体内の代謝変化と密接に関わっており、時には収束が追いつかず深刻化することで臓器不全に至る。欧米型の食生活による食習慣の乱れや、高齢化によって、日本が直面している疾病構造は従来と比べて大きく変化しており、炎症が収束しきれないことで起こる臓器の構造・機能変性を伴う疾患が死因の上位を占めている。重症喘息をはじめとした慢性疾患は、根治治療法が依然として確立していない。そのため、炎症収束の制御を目指した研究は、今後ますます増える食生活の変化や高齢化社会によって生じる医療問題に対応するための重要課題となっている。
今回は肺に焦点をあてた研究だったが、Acsbg1をなくすと肝臓組織中の制御性T細胞も著しく減少することが明らかになっている。指定難病にもなっている自己免疫性肝炎は未だ病因が解明されていないが、肝臓組織中の制御性T細胞が関与している可能性がある。今後、重症喘息や自己免疫性肝炎に有効な治療方法の開発に、「代謝で免疫を制御する」ことの重要性は高まると、研究グループは推察している。
▼関連リンク
・かずさDNA研究所 ニュース



