亜急性期脳梗塞治療を目的に、マウス運動機能回復能を発揮・臨床応用可能な新規超分子ペプチドゲル開発へ
東京医科歯科大学は11月15日、体内投与した箇所でタンパク質を効果的に徐放するゲル、ジグソー型ペプチド「JigSAP」を開発したと発表した。この研究は、同大統合研究機構の味岡逸樹准教授(神奈川県立産業技術総合研究所(KISTEC)「超分子ペプチドを用いた脳梗塞の再生医療」プロジェクトリーダー兼任)、東京農工大学大学院工学研究院の村岡貴博教授、矢口敦也大学院生(博士)、KISTECの押川未央元研究員、北里大学、台湾國立陽明交通大學、名古屋市立大学の研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
脳梗塞は、手足の麻痺などの後遺症が残ることが多く、患者や家族のQOLを著しく低下させるため、社会問題となっている。また、国内の脳梗塞患者にかかる年間総費用は2兆円を超えると言われているが、20年後には患者数が2倍になると予想されており、脳梗塞患者の健康寿命の延伸が重要課題とされている。
現在、脳梗塞の治療には血栓溶解治療と血栓回収治療が有効だとされているが、それぞれ発症から4.5時間以内と8時間以内に治療が限定され、概ね発症1週間後の亜急性期かつ重度の患者に対して治療効果のある、革新的な治療法開発が待ち望まれている。
今回の研究では、亜急性期の脳梗塞治療を目的とし、脳梗塞モデルマウスの運動機能回復能を発揮し、臨床応用可能な新規超分子ペプチドゲルの開発を目指した。
脳梗塞発症1週間後マウスへ脳内投与、脳損傷周辺部の血管新生促進/ニューロン細胞死抑制効果など確認
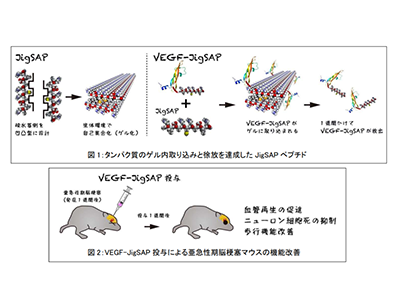
タンパク質をゲル内に取り込ませることとゲル外に放出させることはトレードオフの関係にあり、両方を同時に達成することは技術的に難しいという問題点がある。両親媒性ペプチドは自己集合によりゲル化することが知られているが、アミノ酸側鎖の疎水基側は平面状になっているため、その疎水性相互作用による凝集力が強く、両親媒性タグを付けたタンパク質の取り込みには優れているものの、効率的に徐放させることが困難だった。
そこで研究グループは、両親媒性ペプチドの疎水基側をジグソーパズルのような凹凸型に設計することで、生体環境でゲル化する両親媒性ペプチド「JigSAP」を開発。生体と同等環境での試験により、VEGFのC末端側に「JigSAP」配列を付加した「VEGF-JigSAP」を過剰量の「JigSAP」と混合してゲル化すると、1週間ほどかけて「VEGF-JigSAP」がゲルから徐々に放出されることが明らかになった。
この「VEGF-JigSAP」と「JigSAP」の混合物を脳梗塞発症1週間後のマウス脳内に投与すると、脳損傷周辺部における血管新生促進効果とニューロンの細胞死抑制効果、脳梗塞により生じた歩行機能傷害の改善効果が認められた。
超分子ペプチドゲル、安全性高く、臨床応用に期待
幹細胞を移植する脳梗塞の再生治療が注目を浴びているが、安定した品質の細胞供給は容易ではなく、大量生産ができる医薬品等の開発が待ち望まれている。超分子ペプチドゲルは、体内分解後も元のペプチドになるため安全性が高く、臨床応用が期待される。
亜急性期の脳梗塞患者に対して高い治療効果を発揮する医薬品等は未開発であり、今回の研究成果は、亜急性期脳梗塞に対する細胞フリー再生医療を実現する第一歩となった、と研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




