雌XXで雄XY、X連鎖遺伝子は多すぎ/少なすぎないように補正されている
京都大学は11月19日、カニクイザルを用いた実験で、霊長類におけるX染色体遺伝子量補正プログラムを世界に先駆けて解明したと発表した。この研究は、同大高等研究院ヒト生物学高等研究拠点(WPI-ASHBi)拠点長の斎藤通紀教授(兼:京都大学大学院医学研究科教授、京都大学iPS細胞研究所連携主任研究者)、同ASHBiの岡本郁弘特定講師らの研究グループによるもの。研究成果は、「Science」に掲載されている。
画像はリリースより
哺乳類の性染色体構成は、雌はXX、雄はXYだ。そのため、雌は雄の2倍量のX連鎖遺伝子量を持つことになる。Y染色体の遺伝子は50個ほどなのに対して、X染色体には遺伝子が800個ほどある。このため、雌雄間でX連鎖遺伝子産物量の差を補正するために、雌では2本のX染色体のうち1本を一括して不活性化するメカニズム「X染色体不活性化」が存在する。また、2本ある常染色体との差を補正するためにX連鎖遺伝子の発現量を2倍化する「X連鎖遺伝子のアップレギュレーション」が存在する。
マウスとヒトとでは調整メカニズムが異なるので霊長類のカニクイザルで研究
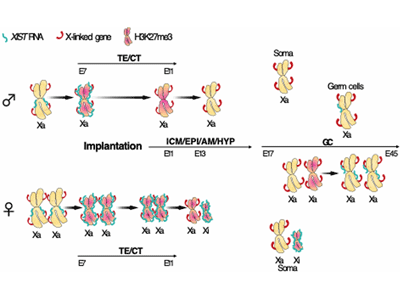
哺乳類のX染色体遺伝子量補正は胚発生初期の着床前後胚で起こる。マウスでは、X染色体不活性化に必須のXIST遺伝子は2細胞期より、父由来のX染色体からのみ発現し、胚盤胞期に全ての細胞で父由来のX染色体が選択的に不活性化される。この父由来X染色体の選択的不活性化は着床後、将来、胎盤などを形成する胚体外部では維持されるが、エピブラストでは再活性化された後、父母由来のX染色体はランダムに不活性化される。
ヒトでは、マウスとは異なり、着床前胚でXIST遺伝子は両方のX染色体から発現するが、X連鎖遺伝子の発現抑制は起きておらず、いつどのようにX染色体遺伝子量補正が起きるのかは不明だった。そこで、今回の研究は、カニクイザルをモデル動物として用いて、霊長類の初期発生過程におけるX染色体遺伝子量補正プログラムを明らかにすることを目的として行われた。
XIST遺伝子発現が適切なタイミングで変化し補正していた
まず、着床前胚におけるXIST とX連鎖遺伝子の発現を解析。すると、ヒト着床前胚と同様にXISTは父母由来の両X染色体から発現しているが、X連鎖遺伝子の発現抑制は起こっていないことがわかった。
次に、早期着床後胚におけるXISTとX連鎖遺伝子の発現を解析したところ、まず、着床後2日目(胚齢11日)にかけて胎盤等になる胚体外部で、次に4~6日目(胚齢13~15日)にかけてエピブラストで、最後に4~8日目(胚齢13~17日)にかけて卵黄嚢でXIST遺伝子の発現が片方のX染色体からのみとなり、X連鎖遺伝子は発現抑制されることが明らかになった。また、X連鎖遺伝子発現量を解析したところ、着床前から胚齢20日にかけて約2倍まで発現量が上昇し、常染色体とほぼ同レベルに到達していた。
さらに、始原生殖細胞では分化初期からXIST遺伝子の発現が低下し、両X染色体から遺伝子発現が再開していると判明。また、始原生殖細胞が生殖隆起に移動後、両X染色体からXIST遺伝子の発現が再開していることも明らかになった。
生殖医療の発展に役立つことが期待される
以上より、今回の研究により、今まで不明だった霊長類の初期発生過程と始原生殖細胞の分化過程におけるX染色体遺伝子量補正プログラムを世界で初めて明らかにすることができた。
研究グループは今後、さらに霊長類のX染色体遺伝子量補正プログラムの分子制御機構の解明を目指し、また、マウスと同様に培養条件下でX染色体不活性化を再現する方法の開発を推進するとしている。これにより、将来的にはヒト多能性幹細胞から卵母細胞を誘導する研究および着床前後胚培養法の技術開発促進、不妊症の原因解明など、生殖医療の発展に役立つことが期待される。




