上皮バリアに重要なTJ形成の誘導因子をマウスで探索
京都大学は11月18日、マウス上皮組織由来の分泌液中に上皮バリア形成を誘導する液性因子が存在することを見出し、新規生理活性ペプチドJIP(Junction inducing peptide)を同定したと発表した。この研究は、同大ウイルス・再生医科学研究所小田裕香子助教・同豊島文子教授らの研究グループによるもの。研究成果は、「Science Advances」にオンライン掲載されている。
画像はリリースより
上皮組織は、生体内外の異なる環境を分けるバリアとして働く。細胞間接着装置のタイトジャンクション(TJ)が、生体内におけるこのバリア機能に必須の役割を果たしており、その分子構築については精力的に研究が行われてきた。一方で、TJがどのようにして形成されるかについては明らかになっていなかった。
小田氏は、TJの構成因子claudinが発現しているだけではTJは形成されない、という自身の観察結果をもとに、生体内にはTJ形成を誘導する因子・機構が存在すると考えた。そこで研究グループは今回、マウス組織の分泌液中におけるTJ形成誘導因子の探索を行った。
TJ形成を誘導する「JIP」発見、炎症回復時のTJバリア再構築への貢献も確認
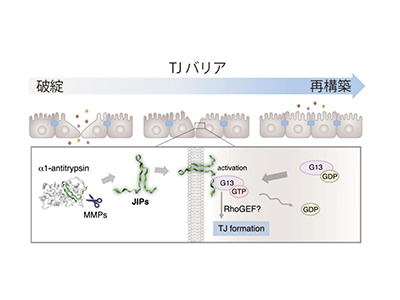
今回の研究では、マウス組織の分泌液の生化学的精製と質量分析解析により、TJ形成を誘導する新規ペプチドを同定し、JIPと名付けた。JIPは、alpha1-antitrypsinのC末端由来の35~40アミノ酸からなるペプチドで、さまざまな培養上皮細胞をJIPで処理すると、TJやTJ様構造が形成されることを見出した。
JIPは、MMP-1、-8、-9によって全長alpha1-antitrypsinから切り出されて産生され、炎症時・炎症回復時に発現が増加することが判明。また、デキストラン硫酸ナトリウム(DSS)誘導性腸炎モデルマウスへのJIP阻害抗体の投与実験から、JIPは炎症回復時のTJバリア再構築に貢献することが示された。
上記の作用機序に迫るため、培養上皮細胞へのJIP抗体の導入実験を実施。その結果、JIPが細胞膜に刺さり、細胞質側にJIPの一部が露出していることが明らかになった。また、in vitro G13活性化アッセイから、細胞質に存在する3量体Gタンパク質G13を直接活性化し、細胞間接着部位のアクチン骨格を再編成することでTJの形成を誘導することが明らかになった。
DSS誘導性腸炎モデルマウスへJIP投与で腸管バリア機能回復、死亡率上昇も抑制
続いて、JIPの炎症病態への効果を検証するために、DSS誘導性腸炎モデルマウスにJIPを投与。その結果、DSSによって破綻した腸管バリア機能が回復し、上皮のクリプト構造が維持されることが示された。同時に、DSS誘導性腸炎モデルマウスの体重減少や死亡率上昇が抑制されることもわかった。
これらの解析により、JIPの培養細胞や大腸炎モデルマウスに対する効果、産生・作用メカニズム、生体内での役割が明らかになった。
がんや炎症などに対する創薬シーズとして期待
今回の研究により、JIPはTJの形成を誘導することで損傷上皮組織の修復に貢献することがわかった。
敗血症患者の血清や、乳がん患者の乳汁にJIPヒトホモログが高発現していることが報告されている。TJの破綻は、がんや炎症の進行と深く関わっていることからも、JIPはこのような病態に対する創薬シーズとして期待される、と研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る



