ポマリドミドの新規治療作用を見出すべく、ネオ基質をベースに研究
東京医科大学は11月12日、免疫調節薬であり、サリドマイド誘導体でもある「ポマリドミド」の新規治療作用を見出したと発表した。この研究は、同大ケミカルバイオロジー講座の清水誠之客員研究員(大分大学医学部助教)、伊藤拓水准教授および半田宏特任教授(東京工業大学名誉教授)、東京工業大学生命理工学院の山口雄輝教授らの共同研究グループによるもの。研究成果は、「Communications Biology」オンライン版に掲載されている。
画像はリリースより
サリドマイドは1950年代に鎮静剤として開発されたが、深刻な催奇形性を有していることが判明し、市場からの撤退を余儀なくされたことで世界的にも知られている。しかし、それから半世紀以上、サリドマイドの分子機構の研究は続けられ、現在では多発性骨髄腫において優れた治療効果があることが判明し、日本においても処方が認可されている。そして、サリドマイドを基にした薬剤としてレナリドミドとポマリドミドが開発され、免疫調節薬(Immunomodulatory drugs,IMiDs)と総称されている。
レナリドミドは多発性骨髄腫だけでなく、骨髄異形成症候群(5q-)やマントル細胞リンパ腫、濾胞性リンパ腫など複数の血液疾患に効果があることが示され使用が認可されているが、ポマリドミドはレナリドミド耐性やプロテアソーム阻害剤耐性の多発性骨髄腫患者への処方に許可が留まっているという現状がある。
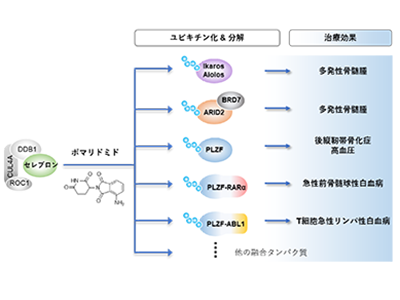
サリドマイド並びにIMiDsの分子機構は、2010年に伊藤准教授と半田特任教授らの研究グループにより、サリドマイドと直接結合する標的因子であるセレブロンが世界に先駆けて発見されたことにより、ここ10年あまりで飛躍的に理解が進んでいる状況にある。セレブロンはユビキチンリガーゼ複合体CRL4の基質受容体として機能し、サリドマイドなど薬剤が結合するとそれに応じて新たな基質(ネオ基質)を認識する役割を担っている。例えば多発性骨髄腫において、レナリドミドやポマリドミドがセレブロンに結合するとIkaros,Aiolosと呼ばれる多発性骨髄腫の生存に重要なタンパク質が認識され、分解されることがこれまでの研究で示されている。
これまで研究グループは東京医科大学において、急性白血病細胞の増殖を抑える化合物CC-885が翻訳タンパク質GSPT1をネオ基質としてセレブロンに認識させることや、サリドマイド催奇形性の原因を担うセレブロンのネオ基質として転写因子p63を発見し、ポマリドミドによる抗多発性骨髄腫効果の一端をセレブロンのネオ基質であるARID2が担っていることなどを明らかにしてきた。研究グループは今回、多発性骨髄腫患者への処方に限られるポマリドミドの新たな有用な治療作用を見出すべく、ネオ基質をベースとしたドラッグリポジショニングを考えた。
PLZF-RARαを発現するモデル白血病細胞株にポマリドミドを処理し、増殖抑制に成功
研究では、さまざまな組織細胞抽出液からポマリドミド依存的なセレブロン結合探索因子を探索。最終的に、神経幹細胞株であるlt-NESの抽出液から得られたセレブロン結合タンパク質サンプルを質量分析で解析した結果、「PLZF(promyelocytic leukemia zinc finger)」が同定された。PLZFは、別名「ZBTB16(Zinc finger and BTB domain-containing protein 16)」と呼ばれる転写因子であり、神経分化や精子形成などさまざまな生命現象に関与することがわかっている。元々は転座によりRARα(Retinoic acid receptor α)との融合により成り立つ融合遺伝子(PLZF-RARα)として発見されている。PLZF-RARαは、急性前骨髄球性白血病の「がんドライバー」として機能することがわかっている。また最近になり、T細胞急性リンパ性白血病において、ABL1との融合によるPLZF-ABL1遺伝子が発見されている。
そこで研究グループは、PLZFおよびPLZF融合タンパク質群について生化学的な解析を実施し、これらがポマリドミド依存的なセレブロンのネオ基質であることを示した。同時に、サリドマイドやレナリドミドによるPLZFの分解活性はポマリドミドより弱いことも示した。また、ヒトマクロファージ様細胞U937にPLZF-RARαを発現させた株がAPL様の性質を有するモデル細胞系として確立されていることから、それを用いてポマリドミド処理を行った結果、臨床的に有効な濃度(0.1μM)で増殖抑制を誘導することに成功した。
APLやT-ALLに対するポマリドミドの適応拡大に期待
今回の研究により、PLZFおよびその融合タンパク質(PLZF-RARαおよびPLZF-ABL1)がポマリドミドで効率よく分解されることや、融合タンパク質発現モデル細胞の増殖抑制が達成されたことにより、これらをがんドライバーとするAPLやT-ALLに対するポマリドミドの適応拡大のための臨床研究への道が開けたと言える。
PLZFは最近の報告では後縦靭帯骨化症や高血圧に関わることも知られており、いずれもPLZFを減少させると改善させ得るという効果が報告されている。その点でポマリドミドはこれらの疾患の治療に有用である可能性が見出され、今後検討の余地があるとしている。
近年、ゲノムシーケンス技術の発展により、さまざまな融合タンパク質が発見されつつある。同研究では解析されていないが、T-ALLにおいてはIkaros-notch融合タンパク質が見つかっており、これは構造的にポマリドミドで分解可能であることが予測されるという。今後、さらにポマリドミドで分解可能な融合タンパク質候補が見つかることも期待される。
「セレブロンのネオ基質に関する情報・知見は蓄積されてきており、今後のがんドライバーとしての融合タンパク質研究がさらに大いになされ、ポマリドミドの用途がさらに広がっていく可能性も期待できる」と、研究グループは述べている。
▼関連リンク
・東京医科大学 プレスリリース



