免疫不全の難病PID、原因遺伝子や病態はさまざま
理化学研究所(理研)は11月12日、米国で見つかった原発性免疫不全症(PID)の家族症例の解析から、PIDの新しい原因遺伝子変異としてAIOLOS転写因子をコードする遺伝子の「ミスセンス変異」を同定したと発表した。この研究は、理研生命医科学研究センター免疫転写制御研究チームの谷内一郎チームリーダーらの国際共同研究グループによるもの。研究成果は、「Journal of Experimental Medicine」オンライン版に掲載されている。
画像はリリースより
PIDは、先天的な遺伝子変異が原因で免疫細胞の分化異常や機能異常が起こり、免疫系が機能不全となるために感染症を繰り返す。時には生後間もなく重篤な感染症にかかり死亡する可能性もあることから、PIDは迅速な診断と適切な治療を必要とする難病指定疾患となっている。その原因となる遺伝子変異はさまざまで、それによってPIDの病態も異なる。
AIOLOS転写因子の変異がPIDの原因となるかは不明だった
AIOLOS転写因子はIKAROS転写因子ファミリーの一員であり、特定のDNA配列に結合して、遺伝子の発現を調節する。IKAROS転写因子ファミリーは、それ自体、あるいはファミリーメンバーと二量体を形成することで機能する。主に血球系細胞で発現しており、リンパ球をはじめとする免疫細胞の発生に重要な働きをすることが知られている。
AIOLOS転写因子はIKZF3遺伝子(通称AIOLOS遺伝子)にコードされており、B細胞をはじめとするさまざまな免疫系細胞で発現が見られる。遺伝子を改変しAIOLOSを完全に欠損させたマウスでは、自己抗体産生などのB細胞の機能異常が見られるが、B細胞の初期発生では大きな変化は示されず、AIOLOSの変異がPIDの原因となるかは不明だった。
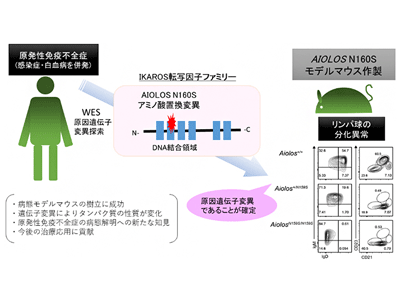
谷内一郎チームリーダーらは2021年に東京医科歯科大学との共同研究において、B細胞欠損を特徴とするPID家族症例の原因遺伝子変異が、AIOLOS遺伝子の159番目のアミノ酸のグリシン(G)がアルギニン(R)へ置換される「G159Rミスセンス変異」であることを発表した。また、AIOLOS転写因子のN160(160番目のアスバラギン)に相当する、IKAROS転写因子ファミリーのN159(159番目のアスパラギン)のミスセンス変異がPIDの原因であることが海外の研究で報告されている。
米国の家族症例を発見、AIOLOS遺伝子のN160Sミスセンス変異を同定
PIDは早期の対応が必要な疾患であり、国際的な研究協力関係が構築されている。PIDは、その原因となる遺伝子変異を同定することが重要であり、近年性能が飛躍的に向上している次世代シークエンサーで、タンパク質をコードする遺伝子の配列を全て解読する全エクソーム解析を用いて、原因遺伝子変異を探索する方法が汎用されている。
国際共同研究グループは、血液中の抗体量の低下、B細胞やT細胞の減少が見られ、肺炎を繰り返し発症するPIDの米国の家族症例を発見した。PID症状がある患者と健康な親、兄弟のDNAサンプルについて、全エクソーム解析したところ、AIOLOS遺伝子の160番目のアミノ酸のアスパラギン(N)がセリン(S)に置換される「N160Sミスセンス変異」を同定した。
N160S変異型AIOLOSはドミナントネガティブ変異体として機能
AIOLOS転写因子が属するIKAROS転写因子ファミリーは、タンパク質の中央に4個、C末端側に2個のジンクフィンガー領域を持っており、特に中央のジンクフィンガー領域はDNAと結合するのに重要だ。加えて前述のように、AIOLOSのN160に相当するIKAROSのN159残基のミスセンス変異がPIDの原因であること、AIOLOSではN160の隣のG159残基のアルギニン(R)への置換を来たすG159R変異がPIDの原因となることがこれまでにわかっている。これらの背景から、今回はAIOLOS N160S変異に着目し、N160S変異型AIOLOSの機能を調べた。
試験管内で転写因子と特定の配列を持つDNA断片との結合を調べるEMSAという方法で、正常のAIOLOSとN160S変異型のAIOLOSのDNA結合能を調べた結果、N160S変異型AIOLOSは正常AIOLOSが認識するDNA配列へ結合する能力を喪失していた。また、正常AIOLOSとN160S変異型AIOLOSを同時に発現させると、正常AIOLOSのDNA結合能が減弱し、細胞内局在も影響され、正常な核内染色パターンが消失することがわかった。この結果は、N160S変異型AIOLOSの存在により、正常AIOLOSの機能が阻害されることを示しており、N160S変異型AIOLOSはドミナントネガティブ変異体として機能することが判明した。
ヒト変異と同一変異の遺伝子改変マウスの作製に成功、PID表現型を確認
試験管内でのN160S変異型AIOLOSの機能解析結果は、この変異が前述のPID家族症例の原因遺伝子変異であることを強く示唆しているが、現時点では検証不十分だ。このような場合、同じ変異を持つ複数の患者を見つけること、または動物に同じ変異を導入して、患者と同じ病態を示すかを調べる必要がある。
谷内一郎チームリーダーらは、2021年にAIOLOS G159R変異を導入した遺伝子改変マウスを作製し、作製したマウスではB細胞が減少したことを報告した。そこで、CRISPR/Cas9ゲノム編集技術を用いて、ヒトAIOLOS N160S変異に相当するAiolos N159S変異を導入した遺伝子改変マウス(ヘテロ変異接合体とホモ変異接合体)を作製した。作製したマウスでは、ヒトの患者と同様にT細胞およびB細胞の分化異常が見られた。
患者と同じヘテロ変異接合体のマウスでは、脾臓における成熟した濾胞性B細胞やパイエル板における濾胞性Tヘルパー細胞の減少が見られた。ホモ変異接合体のマウスでは、上記の免疫細胞の発生障害がより顕著で、血清中の抗体価(具体的にはIgM、IgG、IgAの量)はヘテロ変異接合体のマウスでは、やや年を取ったマウスでIgMの低下が見られた。一方で、ホモ変異接合体のマウスでは、若年からIgM、IgG、IgA全てが低下した。
以上の結果から、Aiolos N159S変異は、マウスでもヒトPIDと同様なB細胞およびT細胞の発生障害というヒトの患者と類似のPID表現型を示したことから、AIOLOS N160S変異が今回のPID家族症例の原因遺伝子変異であることが証明された。
発症の分子機序解明と治療応用に期待
今回の研究は、Aiolos N159S変異マウスでヒトの患者と同じような免疫不全症が再現できるかという点に重点が置かれた。そのため、AIOLOS N160S変異がどのようにしてリンパ球を中心として免疫細胞の発生を障害するのかという分子機序についてはまだ不明だ。治療という側面では、創薬の分子標的を明らかにすることが重要であり、今後Aiolos N159S変異マウスを用いた研究により、分子病態が解明されるものと期待される。
これまでに国際共同研究グループは、AIOLOS G159R、N160S変異のモデルマウスを作製・解析したが、IKAROS N159S変異のモデルマウスはまだ検証段階にある。研究グループは今後、IKAROS N159S変異モデルマウスの作製・解析を行うことで、IKAROS転写因子のファミリータンパク質間における類似の変異により、どのような分子機序で疾患が発症するかを解明し、転写因子のミスセンス変異(一アミノ酸置換)を原因とする疾患の発症機序を明確にしていく予定だとしている。
▼関連リンク
・理化学研究所 研究成果




