iCAR-ILC-N101、腹腔内投与の安全性および忍容性を検討
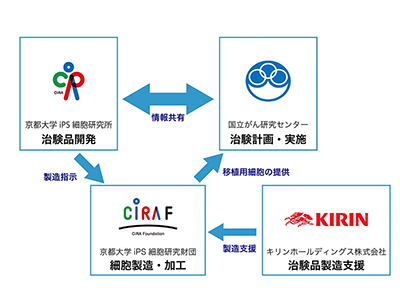
京都大学iPS細胞研究所(CiRA)は11月11日、抗Glypican 3(GPC3)-CAR発現iPS細胞由来ILC/NK細胞(開発名:iCAR-ILC-N101)について、腹腔内投与の安全性および忍容性を検討する第1相臨床試験で、第1症例目の被験者に対する投与を実施したと発表した。この研究は、同研究所の金子新教授ら、国立がん研究センター東病院の研究グループによるもの。
画像はリリースより
CAR遺伝子導入T細胞(CAR-T細胞)やCAR遺伝子導入NK細胞(CAR-NK)などによるがん免疫療法は、一部のがんに劇的な治療効果を発揮することがわかってきている。金子新教授らの研究グループは、これまでにiPS細胞を介した抗原に特異的な再生T細胞や再生NK細胞製剤の開発を進めてきた。特に、HLAホモiPS細胞を用いた再生免疫細胞は、複数の患者に使用可能であり、安定供給が見込める。また、ゲノム編集による免疫細胞の機能強化や細胞疲弊の回避などにも対応できる。
研究グループは、極めてがん特異性の高いタンパク質であるGPC3に着目。日本人において最頻度のHLAをホモでもつiPS細胞(QHJI01s04)にGPC3を認識するCAR遺伝子を導入し、NK細胞(開発名:iCAR-ILC-N101)へと分化させた。GPC3をよく発現する卵巣明細胞がんを対象として、iCAR-ILC-N101を使用した治験を計画。2021年4月から国立がん研究センター東病院にて治験を開始し、9月に第1症例目の細胞移植を実施した。
GPC3発現手術不能進行再発卵巣明細胞がんで腹膜播種病変を有する患者対象に
同試験の対象は、GPC3発現手術不能進行再発卵巣明細胞がんで腹膜播種病変を有する患者。細胞移植については、iCAR-ILC-N101として1回1×106cells/kgを1週間に1回、最大4回にわたり、経皮的に腹腔内に反復投与。用量依存性の毒性の出現に応じて、最小投与例を1回0.5×106cells/kg×最大4回を22日間で、最大投与例を1回3×106cells/kg×最大4回を22日間で投与する。
実施予定人数は、6~18人、実施期間2021年4月12日〜2024年3月31日としている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) プレスリリース




