アスベストに直接接しない中皮細胞はどのようにがん化するのか?
名古屋大学は11月4日、細胞外小胞(EV:エクソソーム、マイクロベジクルなど)が発がん要因となる鉄を輸送しアスベスト発がんの一端を担うことを明らかにしたと発表した。この研究は、同大大学院医学系研究科生体反応病理学の伊藤文哉研究員、梁取いずみ助教、豊國伸哉教授の研究グループが、同大循環器内科学の加藤勝洋病院助教と室原豊明教授による研究グループとの共同研究として行ったもの。研究成果は、「Redox Biology」(電子版)に掲載されている。
画像はリリースより
アスベストはいまだに世界中で多量に使用されており、悪性中皮腫や肺がんのリスクとなる発がん物質として広く問題視されている。アスベスト繊維の発がん機構の研究は2つの観点から進められてきた。すなわち、アスベスト繊維が中皮細胞に取り込まれ、核内へも直接作用することで発がんが起こるという仮説と、アスベストが引き起こす炎症を介して間接的に中皮細胞をがん化させるという仮説だ。研究グループは、後者の分子機構の寄与を仮定して研究をデザインした。
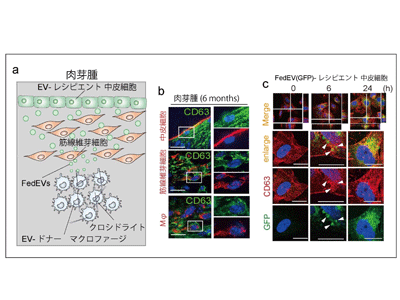
研究グループは昨年、アスベスト曝露により形成される炎症環境(肉芽腫)内部にアスベストがマクロファージに貪食される発がん環境を同定した。その炎症環境を再現した実験系で、中皮細胞はアスベストに直接接していないにも関わらず、がん抑制遺伝子p16INK4aの欠失が確認された。しかし、どのように肉芽腫内のアスベストから中皮細胞へと発がん因子が伝搬するかという疑問は解決されていない。そこで今回、研究グループは、生理活性物質を伝搬するEVに着目し、EVがアスベスト発がんに関与するのではないかという仮説のもとで、発がん性の高いアスベストであるクロシドライト(青石綿)曝露により生じるEVに焦点を定めた実験を行った。
アスベスト<マクロファージ<フェロトーシス<細胞外小胞を分泌
最初に、マウスの腹腔内にクロシドライトを投与するモデルを用いて、生体防御反応として生じる肉芽腫におけるフェロトーシス依存性EV(FedEV)の存在について検討した。蛍光免疫染色の結果から、アスベスト繊維はCD68陽性マクロファージに存在しており、SMA陽性筋線維芽細胞やメゾセリン陽性中皮細胞には確認されなかった。特筆すべき点として、EVのマーカーであるCD63の発現は筋線維芽細胞および中皮細胞において強い顆粒状パターンで認められた。
次に、中皮細胞のFedEV取り込みの実験を実施。GFP-CD63を恒常的に発現するTHP1マクロファージ細胞およびフェロトーシス陽性細胞であるHT1080線維肉腫細胞の2つを樹立し、これらの細胞からGFPがラベルされたEVを回収した。このFedEVを中皮培養細胞MeT-5Aに添加したところ、添加後6~9時間で、FedEVはエンドサイトーシスにて完全に取り込まれることが判明した。とくに、レシピエント中皮細胞の内在性CD63とマクロファージ由来のGFP-CD63は添加後24時間においてサイトゾル(エンドソーム、後期エンドソーム~リソソーム様パターン)に強く共局在していることが判明した。
細胞外小胞に含まれる、発がんに寄与する主な分子は「フェリチン」
FedEVに含有するタンパク質を調べるために、LC-MSによるタンパク質の網羅的解析を行ったところ、FedEVにはフェリチン(FtLおよびFtH)が多く含まれていることが判明。とくに、鉄あるいは鉄とアスベスト繊維の曝露下においてのみ、細胞外小胞の鉄貯蔵タンパク質であるフェリチンが増大することは、鉄過剰病態において重要な点であると考えられる。
次に、FedEV曝露による中皮細胞へのDNA傷害について解析。FedEV曝露後24時間にて、レシピエント中皮細胞の核内でDNAの酸化傷害(8-OHdG)、DNAの2重鎖切断(γH2AX)が増大することが判明した。また、肉芽腫近傍の中皮細胞ではCD63、フェリチン、DNAの2重鎖切断が共存することが確認された。
今回、EVの新たな病態への関与として、発がんに寄与する可能性が示された。今後、EVの発がんにおける役割に関する研究展開が期待できる。同時に、アスベスト発がんにおいてもFedEVが内包するフェリチンや触媒性Fe(II)を中皮細胞へと供与する発がん機構の一端が明らかにされた。この機構は、がん予防のための標的となる可能性がある。研究グループは、「より詳細なFedEVの解析により中皮腫患者のバイオマーカーとしての利用も期待できる」と、述べている。
▼関連リンク
・名古屋大学 プレスリリース



