老化や基礎疾患などにより難治性皮膚潰瘍が誘発される仕組みは?
日本医療研究開発機構(AMED)は11月1日、加齢による皮膚再生能力低下の原因が、XVII型コラーゲンの分解による表皮幹細胞の運動能低下であることをつきとめたと発表した。この研究は、東京医科歯科大学難治疾患研究所幹細胞医学分野の難波大輔准教授と西村栄美教授(東京大学医科学研究所老化再生生物学分野教授兼任)の研究グループと、大阪大学の土岐博特任教授、国際医療福祉大学の松崎恭一主任教授、愛媛大学の佐山浩二教授および白石研講師との共同研究によるもの。研究成果は、「Journal of Cell Biology」オンライン版に掲載されている。
画像はリリースより
高齢者に多い皮膚潰瘍や床ずれは、生活の質(QOL)ならびに寿命に大きく関わることから、超高齢化社会においてその対策が喫緊の課題となっている。加齢そのものによる皮膚の再生能力の低下に加え、糖尿病など加齢に関連する基礎疾患が、糖尿病性足潰瘍や静脈性下肢潰瘍、褥瘡(床ずれ)に大きく関与している。これらの難治性皮膚潰瘍では、老化や基礎疾患による創傷治癒の遅延に細菌感染を伴うことが多く、細菌叢バイオフィルムが形成されてさらに難治性となり、重症例では下肢切断が必要となる。難治性皮膚潰瘍の重症化を防ぐため、早期段階からの治療が必要だが、効果的な治療法はいまだに開発されていない。
皮膚の再生では、周囲の表皮が欠損部分に移動し、その部分を覆う上皮化というプロセスが必須となる。常に細胞が入れ替わる組織である表皮の恒常性は表皮幹細胞が担っており、皮膚再生時の上皮化にも、この表皮幹細胞が関与していることが知られている。老化や基礎疾患などによって難治性皮膚潰瘍が誘発される環境では、この表皮幹細胞の機能が障害されている可能性が示唆されていたが、その仕組みについては解明されていなかった。
表皮増殖因子受容体の活性化が加齢に伴って減少
研究グループは、まず採取されたヒト皮膚から表皮細胞が集団で移動する様子を、培養系で観察することに成功した。この表皮細胞の集団移動は、皮膚の傷が治る際の上皮化と同じ細胞の運動形態であり、同様の表皮細胞の集団運動は、ヒト表皮幹細胞が培養系でコロニーとして成長する際にも観察された。このことは、ヒト表皮幹細胞のコロニー形成が、上皮化研究の優れたモデルであり、培養系でのヒト表皮幹細胞の運動様式の解明が上皮化の仕組みの解明につながることを示している。
次に、ヒト表皮幹細胞コロニーと幹細胞ではない表皮細胞が作るコロニー内での細胞の速度を調べたところ、幹細胞コロニー内の細胞の方が、素早く移動していることがわかった。さらに、ヒト表皮幹細胞の増殖や運動パターンを解析し、それらをモデル化することで、コンピューター内で表皮幹細胞の増殖を再現することにも成功した。そのシミュレーションから、表皮幹細胞が自己複製し、コロニーが成長するには、表皮幹細胞の運動能力が必須であることが判明した。
加齢による皮膚再生能力の低下には、上皮化の速度低下が関与していることが報告されている。そこで、研究グループは、若齢マウスと老齢マウスに傷を作製し、傷が治る過程でのさまざまな因子の活性状態を調べた。すると、表皮増殖因子(Epidermal Growth Factor:EGF)受容体の活性化が、加齢に伴って減少することがわかった。そこで、培養系にEGFを添加し、ヒト表皮幹細胞のEGF受容体を活性化したところ、実際に表皮幹細胞の運動能力だけでなく、増殖能力も増加することを確認した。この結果は、コンピューターシミュレーションで示されたヒト表皮幹細胞の運動能と自己複製能の相関を、培養系で実証するものだ。
COL17A1、細胞骨格を介してヒト表皮幹細胞の運動性を制御
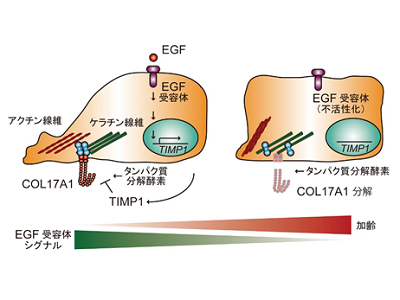
続いて、EGF受容体の活性化が、表皮幹細胞の維持に必須であるXVII型コラーゲン(COL17A1)の量を増加させることを見出した。詳細な生化学的な解析から、ヒト表皮幹細胞では、EGF受容体が活性化すると、TIMP1と呼ばれるタンパク質分解酵素の活性を阻害するタンパク質の発現が誘導され、このTIMP1によって、細胞膜にあるCOL17A1が分解されずに安定化することが明らかとなった。以上の結果は、これまで知られていなかったEGF受容体シグナルによるCOL17A1の安定化という、全く新しいCOL17A1の制御機構の存在を示しているという。
研究グループはこれまでに、COL17A1は表皮幹細胞の機能維持に必須であることを明らかにしていたが、細胞レベルでの詳細な仕組みはまだ明らかになっていなかった。そこで、表皮幹細胞でのCOL17A1の発現量を抑制する実験を実施。表皮幹細胞の運動性が低下し、表皮細胞集団が移動する速度が大きく低下することを見出した。詳細な観察を行った結果、表皮幹細胞が移動する場合、その先端部分で細胞の運動性に関与する細胞骨格であるアクチン線維とケラチン線維の排他的な分布パターンが観察されるが、COL17A1の発現量を抑制すると、このパターンが変化し、アクチン線維の領域が大きく減少することがわかった。
通常の表皮幹細胞では、EGF受容体にEGFなどが結合することで、EGF受容体シグナルが活性化し、タンパク質分解を阻害するTIMP1が細胞外に分泌されている。このTIMP1が、COL17A1の分解を防ぎ、COL17A1が細胞膜上で安定に存在することで、アクチン線維とケラチン線維のネットワーク形成により、表皮幹細胞の高い運動能力が維持される。しかし、加齢によってEGFなどが減少し、EGF受容体が不活性化状態になると、TIMP1が継続的に供給されずに細胞膜上のCOL17A1が分解され、最終的に細胞骨格のネットワーク形成の破綻により、表皮幹細胞の運動能力が大きく低下する。このEGF受容体-TIMP1-COL17A1経路の不活性化が、加齢に伴う皮膚再生能力の低下に大きく関与していると考えられた。
難治性皮膚潰瘍の病態解明と新規治療法開発に期待
ヒトにおいては、加齢に伴って皮膚でのCOL17A1の量が減少することが報告されているが、同様にEGF受容体を活性化するEGFの量も、血液中などで減少することが報告されている。今回研究グループが見出したEGF受容体-TIMP1-COL17A1経路の不活性化が、皮膚再生能力の低下の引き金になると考えられることから、糖尿病性潰瘍や床ずれなどの難治性皮膚潰瘍の発症とも、大きく関連している可能性があり、研究成果は、これらの病態の発症機構の解明を大きく前進させると考えられる。「この経路を活性化することで、加齢によって低下した皮膚再生能力の改善や、難治性皮膚潰瘍に対する新しい治療法の開発が期待される」と、研究グループは述べている。
▼関連リンク
・日本医療研究開発機構(AMED) ニュース



